Study on effect of exogenous microbial consortia on lipid variations during the degradation of Ulva prolifera in seawater system
-
摘要: 通过一系列海水培养实验,模拟外源微生物影响下浒苔在近海海域的降解情况。通过追踪培养体系中浒苔脂类生物标志物随培养时间的变化,探究外源微生物影响下浒苔在海水中的降解机制。结果表明,浒苔中不同存在形态的脂肪酸与中性脂在添加外源降解微生物与未添加外源微生物的培养体系其含量均呈现为先快速下降后缓慢下降或保持稳定的趋势。在外源微生物的影响下,浒苔脂肪酸与中性脂的降解率均有不同程度的提升。应用多元G(multi-G)模型对几种典型浒苔脂肪酸和中性脂的降解过程进行拟合,结果显示,这些脂类化合物在培养体系中都可以分为降解较快和较慢的部分,在添加外源微生物菌群的情况下,其降解速率均有不同程度的提升,幅度在20%−30%。在外源环境微生物的影响下,不同种类浒苔脂肪酸的降解率与降解速率没有显著差别。在海水中,结合态脂类化合物的降解速率与降解率均显著高于其游离态,显示浒苔脂类化合物的存在形态对其降解过程有显著影响。外源微生物的加入提高了浒苔脂类化合物降解较慢的部分的降解速率,从而在整体上促进了浒苔的降解。Abstract: A series of seawater culture experiments were conducted to simulate the degradation of Ulva prolfiera in coastal area under the influence of exogenous degradation microbial consortia The degradation mechanism of Ulva prolifera in seawater under the influence of the exogenous degradation microbial consortia was investigated by tracking the time-dependent changes of lipid biomarkers in culture system. The results showed that for most of the fatty acids (14:0, i-15:0 + a-15:0, 16:0, 16:1ω7, 17:0, 18:0, 18:1ω7, 18:1ω9, 18:3, 18:4, 20:0, 22:0) and neutral lipids of Ulva Prolifera in different forms, their contents presented trends of first rapid decline and followed by a slow decline or maintain stability in the culture system with and without exogenous microbial consortia. Under the influence of exogenous microbial consortia, the degradation efficiency of fatty acid was generally increased by 10%−20%, while that of neutral lipids increased by 15−25%. The multi-G model was applied to fit the degradation processes of several fatty acids and neutral lipids, the results showed that the lipids could be divided into fast and slow degradation fractions in the culture system, and their degradation rates were improved in different degrees, with the range of 20% to 30% with the addition of the exogenous microbial consortia. Under the influence of the exogenous microbial consortia, there was no significant difference in the degradation efficiency and rates of different fatty acids in Ulva prolifera. In seawater, the degradation efficiency and rates of lipids in bound forms were significantly higher than that of their free forms, indicating that the existence forms of lipids of Ulva prolifera had significant effect on their degradation processes. The addition of exogenous degradation microbial consortia increased the degradation rate constants of the slow degradation fractions of the lipids in Ulva Prolifera, thereby promoted its overall degradation .
-
1. 引言
浒苔是一种具有很强适应性的藻类,在盐度7.5~50,温度范围10~30℃,pH值范围6~10的海水环境均可生长[1]。近些年来,每年春夏季浒苔在出现富营养化的我国黄、东海海域呈爆发式生长,覆盖大面积的海域,形成绿潮灾害[2−3]。为了应对绿潮灾害,各方面发展了多种技术,如直接打捞、控制浒苔源头生物量、开发浒苔的利用技术等,但到目前为止,这些方法都不能有效解决浒苔绿潮问题[4–7]。寻找新的治理手段仍然是现阶段应对浒苔绿潮问题的关键。
在海洋中,浒苔漂浮在表层海水,容易随海流大范围扩散,影响更广阔的水域。浒苔是海洋中的初级生产力,异养微生物都有可能利用其作为自身生长的碳源和能量来源从而实现对其的降解。因此有学者提出,可以通过微生物处理的方法,在减小浒苔形成规模的同时,加速其沉降,从而抑制其扩散,缩小浒苔绿潮的影响范围,降低其危害[8]。应用这种方法治理浒苔绿潮,效率与成本等均优于目前常用的打捞手段,日益受到各方面的广泛关注。目前已有学者已从腐烂浒苔或以浒苔为食的动物体内提取到了多种浒苔降解菌,能够快速降解浒苔细胞壁及大分子多糖。例如,朱强等人从浒苔绿潮爆发水域的海水、海泥及腐烂液中分离出了一种假交替单胞菌属海洋细菌,其对浒苔降解率可在3天内达到68.1%[9]。谢罗翰等人从黄斑篮子鱼肠道菌群中分离出了一种代号为B30的浒苔多糖降解菌菌株用于基于浒苔的生物燃油的生产,结果表明该菌种可合成酶活力最高可达250 U·mL−1 的浒苔多糖降解酶[10]。上述研究主要集中在能够促进浒苔商品化应用的领域,研究方向主要集中于寻找能够降解浒苔细胞壁和浒苔多糖的单一微生物,而对浒苔中其他化合物在降解研究则几乎没有涉及,对天然环境中微生物降解浒苔过程和机制的研究更加缺乏[11–14]。利用外源微生物降解浒苔,目前相关的文献报道极少。Dong[5]等将包含杆菌和酵母菌的微生物降解菌群喷洒到浒苔表面,经过7天的发酵处理之后,研究其在海水中的降解情况。结果表明,经过此方法处理的浒苔在海水中的降解速率比未经处理的浒苔提高了14倍。在他们的海水培养体系中,变形菌门、拟杆菌门、杆菌门、浮霉菌门、放线菌门的微生物大量出现,并且在不同的培养阶段微生物群落结构和丰度变化显著,表明海洋环境中降解浒苔微生物的多样性和易变性。但是他们的研究追踪的是整个培养体系溶解有机物的变化,没有直接体现浒苔本身在海水中的降解过程。
脂类是参与生命活动的重要化合物,包括脂肪酸和中性脂,大多数藻类中其含量低于其干重的5%[15–18]。与多糖和蛋白质相比,脂类化合物具有较高的稳定性与种属专一性,能够作为藻类的生物标志物,在海洋有机物降解研究中也有广泛的应用[19–22]。例如28-异褐藻甾醇是一种在浒苔中含量较高的甾醇化合物,其作为绿潮藻类生物标志物的可行性已经得到证实[20]。耿慧霞团队发现在浒苔爆发水域的表层沉积物中可检测到大量28-异褐藻甾醇,从而建立了追踪浒苔沉降区的方法[21]。彭全才等对包括两种浒苔在内的8种海藻脂肪酸研究的结果表明,海藻脂肪酸组成的差异能够成为辅助海藻分类的一种技术手段[23]。He等研究了不同氧饱和度海水中海藻脂肪酸的降解,进一步证实了溶解氧在藻源有机物降解中的关键作用[24]。以脂类化合物作为生物标志物追踪有机物在海洋环境中的降解过程,是研究海洋藻类降解机制的重要方法,但是到目前为止,通过追踪不同种类脂类化合物的变化研究海洋环境浒苔的降解过程尚没有文献报道。
将降解浒苔的外源微生物应用于浒苔治理领域,需要遵循确保天然海域浒苔在降解过程不能产生造成二次污染的物质或者可能诱发次生灾害的产物,也不能破坏治理区域的生态环境和生物多样性等原则[25−26]。基于这些原则,本研究将从受浒苔影响严重的青岛近岸海域海水和沉积物中筛选培养扩繁的有机物降解菌群作为外源微生物添加到浒苔海水培养体系中,模拟在外源微生物参与下浒苔在天然海水的降解过程,通过追踪浒苔脂类生物标志物的变化状况,探究应用通过添加外源降解微生物治理浒苔绿潮的可行性。本研究进一步揭示了外源微生物菌群对浒苔降解行为和降解动力学过程的影响,为探索浒苔绿潮的治理手段以及研究有机碳在近海的生物地球化学循环过程提供支持。
2. 材料与方法
2.1 浒苔的收集与培养
实验用浒苔与原位海水于2021年7月取自青岛市崂山区王哥庄镇会场村附近海岸(36.30 °N, 120.66 °E)。将打捞得到的含浒苔的海水样品进行抽滤,根据所收集的浒苔湿重和海水样品的体积估算,每升海水样品中大致有20 g浒苔。将分离的浒苔密封冰冻储存备用。模拟天然海水环境浒苔降解的培养体系由一系列经过450℃马弗炉灼烧的 2 L 大烧杯组成。进行培养实验时,向每个烧杯中加入1 L恢复至室温(25 ℃)的天然海水,随后加入20 g解冻的浒苔样品,摇晃均匀,海水不进行灭菌处理,以模拟浒苔的自然生长环境。培养体系中分为添加外源微生物菌群的加菌组和未加菌组两个培养系列,每个系列有8个样品,总培养时间为12天,分别在培养的第0、1、2、4、6、8、10、12天进行取样。用于实验的外源微生物菌群由青岛浩澳环保科技有限公司从取样点的海水中筛选、培养、扩繁,均为异养微生物。在显微镜下观察,这些微生物大小不一,包括单球菌、双球菌、链球菌、单杆菌、双杆菌以及形态不规则的细菌等。在加菌组中加入相当于浒苔重量1‰的含有外源降解微生物菌群的菌液,具体做法为每1 g浒苔用移液枪加入1 μL菌液,共20 μL,未加菌组对应加入等比例高纯水。根据厂家提供的数据,菌液中的微生物数量为7~10×108 cell·mL-1,加入培养体系的外源微生物的数量为14~20×106 cell。培养实验在GZX-250型恒温光照培养箱(常州国宇)中进行。为模拟夏季浒苔绿潮海域情况,培养温度设定为(26 ± 0.5)℃,光暗周期设定为12 h/12 h,光照强度设定为
4000 lx。取样时将对应组别的烧杯从培养箱中取出,使用砂芯漏斗抽滤分离浒苔与海水,并将浒苔冷冻保存用于进一步分析。2.2 脂类化合物的提取
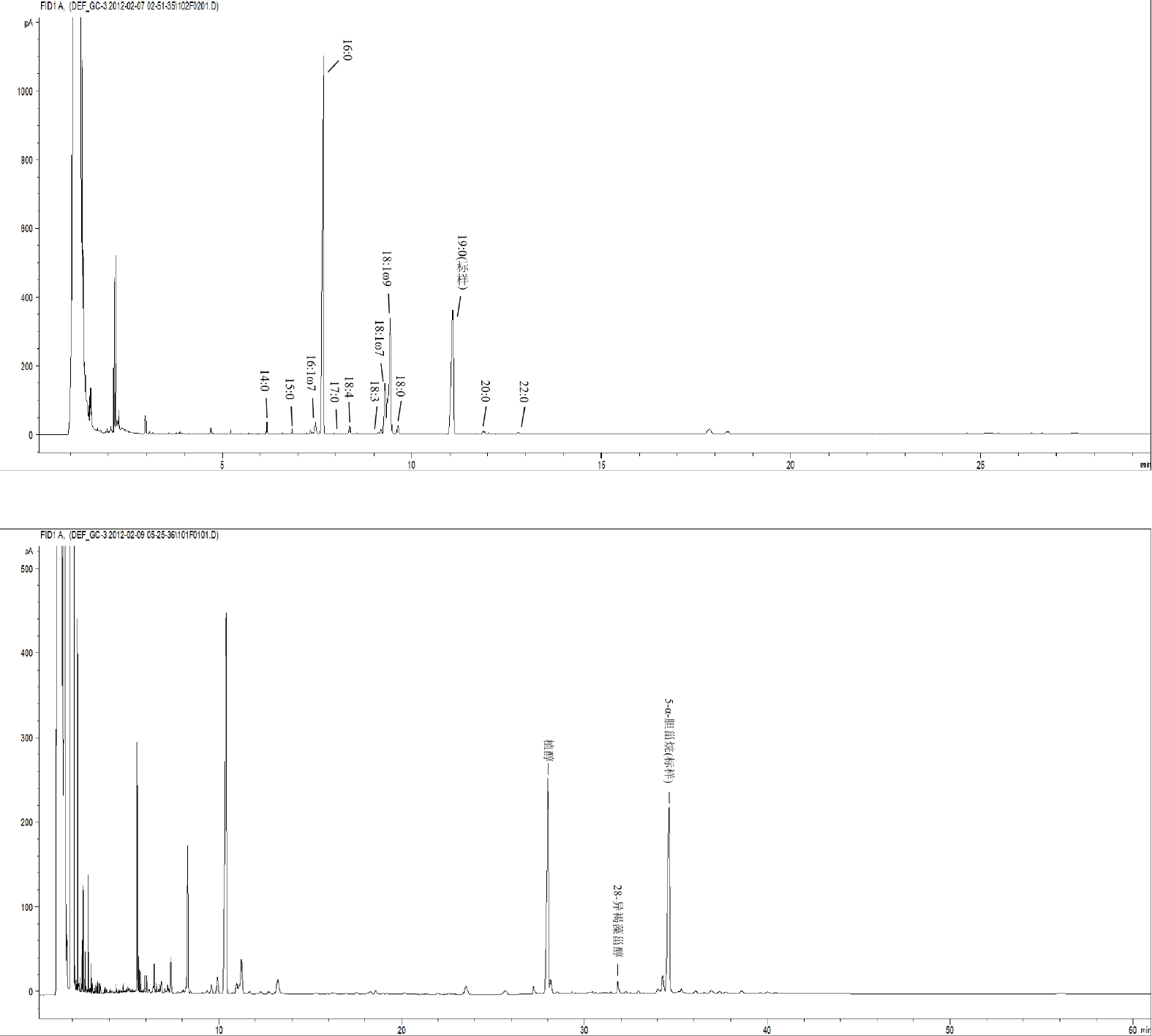
参照Sun等[27]的提取方法对浒苔样品中的脂肪酸进行提取,如图1所示。先取0.5−1 g浒苔样品进行含水量测定。测定方法为将浒苔样品置于烘箱中于80 ℃烘干24小时,测定烘干前后重量差进而求得浒苔含水量。本文中浒苔脂类化合物的含量均为换算后的干重含量。另取1−2 g浒苔样品,转移至手动匀浆器,与10 mL CH3OH混合,充分匀浆后转入50 mL玻璃离心管。先后使用10 mL CH3OH与3×10 mL体积比为2∶1的CH2Cl2/CH3OH混合溶液萃取,每次萃取前先使用Vortex-5 型涡旋混合器(海门麒麟)混合1−2 min,随后使用SB-
5200 型超声波破碎仪(宁波新芝)进行超声处理5 min,并使用GTR16-2B 型低温高速冷冻离心机(北京时代北利)离心10 min(2500 r·min−1)。将每次离心后的上清液转移至同一分液漏斗中,记为萃取液a。然后向离心管中的剩余样品中加入0.5 mol·L−1的KOH水溶液10 mL,放置在HB120-S 型恒温金属浴(北京大龙)中,在100℃条件下加热2小时。停止加热冷却后按前述条件再次进行涡旋混合,超声处理和离心,将所有上清液转移至另一分液漏斗中,记为萃取液b。萃取液a中的脂类化合物为游离态,萃取液b中的脂类化合物为结合态。向分液漏斗中加入5%的NaCl水溶液,直至萃取液产生分层,充分振摇萃取液后,静置6小时以上,下层有机相转移至梨形瓶中。之后使用3 × 10 ml CH2Cl2萃取,重复振摇、静置步骤,并将下层溶液转移至同一100 mL梨形瓶中,获得有机相。将有机相用RE-52CS 型旋转蒸发仪(上海亚荣)蒸发去除有机溶剂。用1 mL 0.5 mol·L−1 KOH/CH3OH溶液润洗梨形瓶,将润洗液转移至25 mL玻璃试管中,重复此步骤三次,并向润洗液中加几滴水。将该试管放置在恒温金属浴中,在100 ℃皂化润洗液2小时。待试管冷却后,加入1 mL 5%的NaCl水溶液,再加入与润洗液等体积的正己烷,振摇混合后,静置4小时以上,将上层有机相溶解转移至50 mL梨形瓶中,重复萃取3次,获得的有机相含有浒苔中性脂。用旋转蒸发仪蒸干该有机相的有机溶剂。用3 × 0.5 mL 正己烷润洗梨形瓶3次,润洗液转移至准备好的4 mL 棕色样品瓶中,重复3次。用99.5%高纯氮气吹干样品瓶中的正己烷,分别加入乙腈和 N, O-双(三甲基硅基)三氟乙酰胺(BSTFA)各100 μL,置于恒温金属浴中,在 100℃条件下加热2小时,将中性脂中的甾族化合物硅烷化。加热结束后冷却至室温,用高纯氮气吹干溶剂,随后加入 100 μL 1 mg·mL−1 的 5-α-胆甾烷溶液作为内标物,并加入100 μL 正己烷形成富集浒苔中性脂样品的溶液。将样品冷藏贮存在4 ℃冰箱中,用于气相色谱(GC)和气相色谱-质谱(GC-MS)分析。
向试管下层的溶液中加入6 mol·L−1 的浓盐酸至pH小于2,将样品中的脂肪酸盐转化为脂肪酸。随后加入等体积的正己烷萃取3次,每次间隔不少于4 h,转移上清液于50 mL梨形瓶中,用旋转蒸发仪蒸干其中的溶剂,用1 mL 10% BF3-CH3OH溶液润洗三次转移至25 mL试管中,再用1 mL CH3OH润洗三次并将润洗液转移至同一试管。将试管放入恒温金属浴于100℃加热2小时,使脂肪酸转变为脂肪酸甲酯(FAMEs)。溶液冷却后,加入与其等体积的正己烷,萃取三次,每次间隔不少于4 h,将上层有机相转移至25 mL梨形瓶中。用旋转蒸发仪蒸干有机相中的有机溶剂,随后用0.5 mL正己烷润洗,润洗液转移至4 mL棕色样品瓶中,重复此步骤3次。用高纯氮气吹干样品瓶中的正己烷。加入100 μL 1 mg·mL−1 的正十九烷酸甲酯(19:0)溶液作为内标物,并再加入100 μL正己烷溶剂。将样品冷藏贮存在 4 ℃冰箱中以备分析时使用。BSTFA,BF3-CH3OH和5-α-胆甾烷来自Sigma Aldrich公司,其它试剂来自国药集团,均为分析纯。
2.3 脂类化合物的定性、定量分析
脂肪酸与中性脂各组分通过GC的保留时间和GC-MS谱图进行定性,采用内标法定量,通过色谱图中目标物与内标物的峰面积相比较,确定浒苔中脂类化合物的含量,计算公式为:
$$ {\mathrm{w}}_{\mathrm{i}}=\frac{{\mathrm{A}}_{\mathrm{i}}}{{\mathrm{A}}_{\mathrm{标}}}·\frac{{\mathrm{c}}_{\mathrm{标}}{\mathrm{V}}_{\mathrm{标}}}{{\mathrm{m}}_{\mathrm{干}}} $$ 其中,wi为待测脂类化合物的质量含量(μg∙g−1),Ai与A标分别为待测物与内标物(即十九烷酸甲酯与5-α-胆甾烷)的气相曲线峰面积,c标与V标分别为加入的内标物的质量浓度(μg·mL−1)与体积(mL),m干为提取实验所用浒苔的干重(g)。
GC(Agilent 6890N,美国)分析条件:HP-5 毛细管色谱柱(25 m × 320 μm × 0.25 μm);使用氢火焰离子化检测器(FID),检测器温度 310℃;进样口温度300℃,进样量 1 μL,无分流进样;载气为高纯氮气,载气流速 1 mL·min−1,H2 流量 35 mL·min−1,空气流量 400 mL·min−1。脂肪酸分析的色谱柱升温程序为: 初始温度50℃,以30℃·min−1升至 200℃,保持1 min后再以5℃·min−1升至215℃,保持2 min之后以 1℃·min−1升温至220℃并保持4 min,最后以20℃·min−1升至310℃并保持5 min。中性脂分析的色谱柱升温程序为:初始温度50℃,迅速以30℃·min−1升至 200℃,保持10 min后再以5℃·min−1升至 215℃,随后以 1℃·min−1升温至220℃并保持2 min,最后以 20℃·min−1升至310℃ 并保持30 min。
GC-MS(Agilent 6890N-5973i)检测条件:HP-5MS 毛细管气相色谱柱(30 m × 0.32 mm, 0.52 μm),用氦气作为载气,离子源用电子轰击源(EI),离子源温度240 ℃,能量 70 eV,全扫描(scan)采集方式。色谱柱升温程序同GC。
2.4 降解动力学模型
海水和沉积物中脂类化合物的降解大多呈现先快速降解后缓慢降解的动力学特征,这种降解行为通常可以采用被称为多元G的动力学模型(Multi-G 模型)进行量化分析,这一模型的准确性已在诸多研究中得到验证[20, 28]。该模型假设有机物不同降解速率部分的降解行为相互独立,通过各不同降解速率部分的加权平均可求得总降解速率,对该模型的描述如下:
$$ \mathrm{-(dG}_{ \mathrm{t}} \mathrm{/dt)=\Sigma k}_{ \mathrm{i}} \mathrm{G}_{ \mathrm{i}} $$ $$ \mathrm{G}_{ \mathrm{t}} \mathrm{=\Sigma G}_{ \mathrm{i}} =(\mathrm{G}_{1})_{0} \exp(-\mathrm{k}_{1} \mathrm{t)+(G}_{2} )_{0} \exp(-\mathrm{k}_{2} \mathrm{t)+{…}} $$ 上述式中,−(dGt/dt) 是脂类化合物总降解速率,ki与Gi分别为该有机物第i部分的降解速率常数与含量,(G1)0和(G2)0是两个不同降解速率部分的初始含量。本文中,将每一种浒苔脂类化合物分为能够快速降解的部分与慢速降解的部分,其降解速率分别为k1与k2,此时,化合物的平均降解速率常数kav可表示为:
$$ \mathrm{k}_{ \mathrm{av}} \mathrm{=k}_{ \mathrm{1}} \mathrm{\times f}_{ \mathrm{1}} \mathrm{+k}_{ \mathrm{2}} \mathrm{\times f}_{ \mathrm{2}} $$ 其中f1 = (G1)0/(Gt)0;f2 = (G2)0/(Gt)0
2.5 外源微生物菌群微生物多样性分析
外源微生物菌群的微生物多样性分析由上海欧易生物科技有限公司完成。外源微生物降解菌群样品以菌液的形式提供。基于16S rDNA测序进行微生物多样性分析,扩增区域为16S rDNA V3-V4区。前端引物为343F (TACGGRAGGCAGCAG);后端引物为798R (AGGGTATCTAATCCT)。根据测序数据确定外源微生物菌群的物种组成。
3. 实验结果
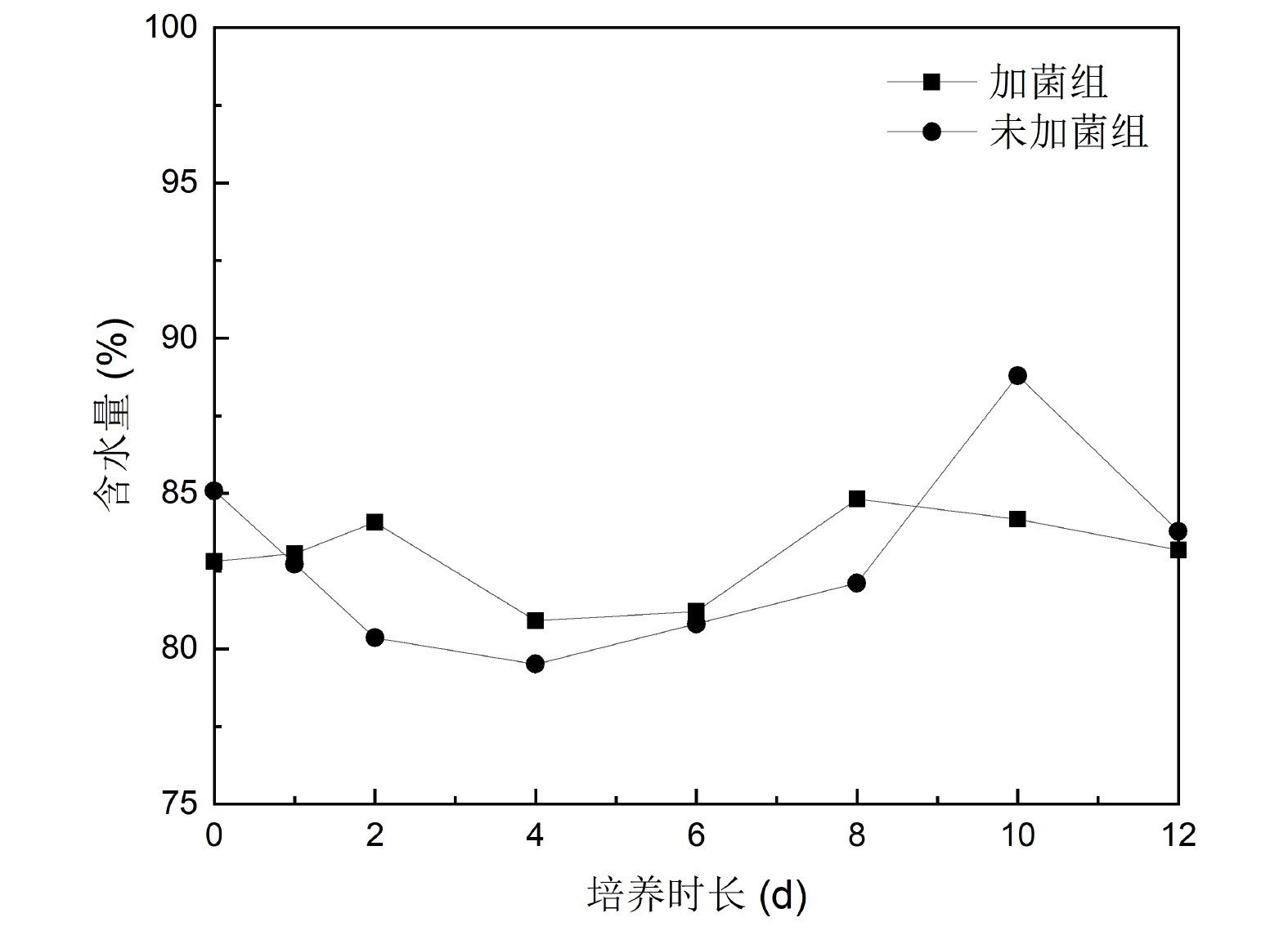
培养期间,随着时间的推移,烧杯中浒苔发生了明显的沉降,且加菌组浒苔的沉降速度与幅度均优于未加菌组(图2)。初步说明外源降解菌对浒苔的沉降有促进作用。含水量分析结果如图3所示。由图可知,加菌组与未加菌组的浒苔含水量在80%−90%之间,均呈现为先下降后上升的趋势。对浒苔中的脂类化合物进行气相色谱分析,结果如图4所示。经鉴定,共得到脂肪酸12种,中性脂两种,包括饱和脂肪酸(14:0、i和a-15:0、16:0、17:0、18:0、20:0、22:0)与不饱和脂肪酸(16:1ω7、18:1ω7、18:1ω9、18:3、18:4)。其中,有四种脂肪酸(i和 a-15:0、17:0、18:1ω9、18:4)在加菌组与未加菌组的初始浓度有较大差异,是有外源降解菌群带入的细菌脂肪酸所致。培养初期(0 d)浒苔中各种脂类化合物(游离态和结合态)的含量如图5所示。
3.1 饱和脂肪酸含量随时间的变化
五种饱和脂肪酸的含量分布如图5-a所示。在饱和脂肪酸中,16:0含量显著高于其他饱和脂肪酸:其游离态与结合态16:0的含量分别为
5573.07 μg∙g−1与2830.83 μg∙g−1,而其他脂肪酸的含量均低于250 μg∙g−1。降解过程中各饱和脂肪酸的游离态含量、结合态含量与通过二者加和得到的脂肪酸总含量随时间变化如图4所示。结果表明,浒苔结合态脂肪酸与总饱和脂肪酸的含量普遍呈现先快速下降,后缓慢下降的特征,但对于游离态脂肪酸,14:0与20:0的含量随时间呈波动变化。根据培养体系脂肪酸的最终浓度和初始浓度计算脂肪酸的降解率(降解率% = 1 − w终/w0,w终为最终浓度,w0为初始浓度),结果如表1所示。加菌组饱和脂肪酸降解率普遍高于未加菌组;未加菌组总脂肪酸的降解率在70%左右,加菌组总脂肪酸降解率则大多处于90%水平。此外,游离态脂肪酸的降解率显著低于结合态。除22:0外,游离态饱和脂肪酸的降解率一般低于60%,而结合态脂肪酸的降解率均高于70%。饱和脂肪酸的降解趋势如图6所示。除游离态14:0与20:0外,浒苔脂肪酸降解呈现先快速下降后缓慢下降的趋势。
表 1 不同浒苔脂肪酸的降解率(降解率为负值表明含量增加)Table 1. Degradation efficiencies of different fatty acids in the Ulva prolifera (negative degradation efficiencies indicate an increase in the content)脂肪酸种类 未加菌组降解率/% 加菌组降解率/% 14:0 游离态 40.2 89.1 结合态 86.9 93.5 总含量 70.5 90.6 16:0 游离态 64.0 91.6 结合态 84.6 92.9 总含量 70.0 91.9 16:1ω7 游离态 42.8 92.3 结合态 99.9 93.9 总含量 53.8 92.7 18:0 游离态 38.2 91.7 结合态 85.6 94.2 总含量 81.7 92.1 18:1ω7 游离态 52.6 78.9 结合态 87.5 80.8 总含量 68.3 79.1 18:3 游离态 79.5 87.6 结合态 82.9 84.9 总含量 79.7 86.9 20:0 游离态 −25.5 −20.7 结合态 94.2 91.3 总含量 71.3 80.1 22:0 游离态 77.2 92.7 结合态 77.8 92.3 总含量 77.6 92.6  图 6 浒苔各饱和脂肪酸中游离态部分含量、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得Figure 6. Time-dependent variations profiles of the contents of free, bound, and total saturated fatty acids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets
图 6 浒苔各饱和脂肪酸中游离态部分含量、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得Figure 6. Time-dependent variations profiles of the contents of free, bound, and total saturated fatty acids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets3.2 不饱和脂肪酸
培养开始时,浒苔中不饱和脂肪酸含量如图5-b所示。在这三种不饱和脂肪酸中,18:1ω7的含量处于较高水平(
3258.83 μg∙g−1),而另外两种含量则相对偏低。图4结果表明,浒苔中不饱和脂肪酸的降解同样呈现为先快速降解后缓慢降解的趋势。不同形态不饱和脂肪酸的降解率如表1所示。与饱和脂肪酸类似,三种不饱和脂肪酸的总降解率同样随着外源降解菌群的引入而显著提升。以16:1ω7为例,随着降解菌群的引入,其降解率由53.8%上升至92.7%。此外,三种脂肪酸在游离态的降解率也都显著低于其结合态。例如未加菌组游离态18:1ω7的降解率为52.6%,而结合态则为87.5%。同饱和脂肪酸相比,不饱和脂肪酸的降解率并未随不饱和度的提升而显著提升。例如,未加菌组总16:0的降解率(70.0%)高于16:1ω7(53.8%)。三种不饱和脂肪酸的降解趋势如图7所示。与浒苔饱和脂肪酸类似,它们在培养体系中同样呈现出现快速下降后缓慢下降的趋势。
 图 7 浒苔各不饱和脂肪酸中游离态部分含量、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得。Figure 7. Time-dependent variations profiles of the contents of free, bound, and total unsaturated fatty acids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets.
图 7 浒苔各不饱和脂肪酸中游离态部分含量、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得。Figure 7. Time-dependent variations profiles of the contents of free, bound, and total unsaturated fatty acids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets.3.3 细菌脂肪酸
如图5-c所示,加菌组和未加菌组的浒苔样品中都可检测到细菌脂肪酸,且普遍以游离态的形式存在。表明天然环境中浒苔能够吸附细菌,并且细菌的脂肪酸在提取过程中更加容易被破坏形成游离态。对于细菌脂肪酸,加菌组与未加菌组呈现不同的变化趋势:细菌脂肪酸在加菌组中呈现先快速下降后缓慢下降的趋势,而在未加菌组中,脂肪酸含量始终在较低水平波动(图8)。整体上,细菌中普遍存在的18:1ω9在加菌组和为加菌组含量都是最高的,并且在大部分培养期间,其在加菌组的含量高于未加菌组。
 图 8 浒苔细菌脂肪酸中游游离态部分含量、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得。Figure 8. Time-dependent variations profiles of the contents of free, bound, and total bacterial fatty acids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets.
图 8 浒苔细菌脂肪酸中游游离态部分含量、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得。Figure 8. Time-dependent variations profiles of the contents of free, bound, and total bacterial fatty acids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets.3.4 中性脂
在浒苔中鉴定出两种典型的中性脂—植醇与28-异褐藻甾醇。前者为叶绿素降解的主要产物,后者是浒苔甾醇的主要成分。两种中性脂主要以游离态形式存在(图5-d),且植醇含量显著高于28-异褐藻甾醇。
两种中性脂的降解情况如图9所示。在加菌条件下它们呈现先快速降解后缓慢降解的特征,但在未加菌组,游离态植醇含量呈现先上升后下降的趋势。
 图 9 浒苔各中性脂中游离态部分、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得Figure 9. Time-dependent variations profiles of the contents of free, bound, and total neutral lipids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets
图 9 浒苔各中性脂中游离态部分、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得Figure 9. Time-dependent variations profiles of the contents of free, bound, and total neutral lipids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets两种中性脂的降解率如表2所示。两种中性脂降解率依然呈现加菌组(约60%)显著优于未加菌组(约30%)的特征。对比游离态与结合态中性脂降解情况的结果表明,未加菌组游离态植醇的降解率(32.8%)高于其结合态(21.1%),而加菌组的中性脂其结合态降解率高于游离态。
表 2 两种浒苔中性脂的降解率Table 2. Degradation efficiencies of the two types of the neutral lipids in the Ulva prolifera脂肪酸种类 未加菌组降解率/% 加菌组降解率/% 植醇 游离态 32.8 52.1 结合态 21.1 78.3 总含量 31.1 58.6 28-异褐藻
甾醇游离态 33.8 55.4 结合态 69.8 97.2 总含量 31.6 62.3 3.5 外源微生物菌群的物种组成
16S rDNA测序的结果表明,外源微生物菌群的主要菌种包括别样海源菌属的肺嗜冷杆菌(Aliidiomarina shirensis)和伊朗别样海源菌(Aliidiomarina iranensis),泛在群杆菌(Candidatus Fonsibacter ubiquis),肉食杆菌属的Carnobacterium maltaromaticum,不动杆菌属的Acinetobacter ursingii,棒状杆菌属的Corynebacterium imitans,红色杆菌亚目的细菌(Rubrobacterineae bacterium), 一种海单胞菌属的细菌(Marinomonassp. MWYL1),变形菌门的Testudinibacter aquarius,尚未定种的γ-变形菌(Gamma proteobacterium SCGC AAA076-P13)未正式定名的海洋细菌Malaciobacter marinus等,布氏乳杆菌(Lactobacillus buchneri),酸鱼乳杆菌(Lactobacillus acidipiscis),菊糖芽孢乳杆菌(Sporolactobacillus inulinus),青春双歧杆菌(Bifidobacterium adolescentis),长双歧杆菌(Bifidobacterium longum),绿色糖单胞菌(Saccharomonospora viridis),乳酸厌氧菌(Anaerotignum lactatifermentans),以及盲肠拟杆菌(Bacteroides caecimuris),食异源物鞘氨醇菌(Sphingobium xenophagum),草地黄丝菌(Luteitalea pratensis),链球菌属的细菌(Streptococcus dysgalactiae Streptococcus sp. FF10),马赛真杆菌属P3202株(Eubacterium sp. Marseille-P3202),普雷沃氏菌属马赛-P2931菌株(Prevotella sp. Marseille-P2931),梭菌目的细菌(Clostridiales bacterium),瘤胃球菌属(Ruminococcus sp.)的细菌,以及一类富集培养的古菌克隆(archaeon enrichment culture clone 43-1),Parcubacteria属细菌,棉子糖乳球菌(Lactococcus raffinolactis)等。其中布氏乳杆菌,酸鱼乳杆菌,菊糖芽孢乳杆菌,青春双歧杆菌,长双歧杆菌,绿色糖单胞菌,乳酸厌氧菌以及耐盐的鲁氏酵母菌(Saccharomyces rouxii)来自厂家的菌种库,其它鉴定出的微生物是厂家从取样点的海水和沉积物中筛选后与来自厂家菌种库的微生物混合扩繁,最终形成了本研究所用的外源微生物菌群。所有鉴定出的微生物都是异养微生物,具有较强的降解有机物的能力。
4. 讨论
4.1 培养体系中的浒苔及细菌脂类化合物
由于海水中的大部分微生物在培养之前经过过滤被去除,因此本研究所鉴定出的脂类化合物,主要来自于浒苔本身和它所吸附的微生物。在这些脂类化合物中,16:0与18:1ω7含量显著高于其他脂类化合物,是两种典型的浒苔来源的脂肪酸[29]。前期对浒苔脂类化合物组成的研究结果表明,18:3也是浒苔中含量较高的脂肪酸。例如在彭全材等人的研究中,浒苔中18:3的含量可达总脂肪酸的21%左右[23]。在我们的研究中,18:3只占总脂肪酸的2.3%。造成这种差异的原因可能是浒苔取样季节与培养环境的不同所致。Ivana等对突尼斯褐藻囊藻的各组分分析结果表明,大型藻类中的脂类化合物的含量会随着季节的变化而产生差异[30]。以植醇为例,5月时褐藻中植醇的含量占总提取物的3.97%,而在8月份则升至14.2%。
对比浒苔各脂类化合物在游离态与结合态中的占比结果表明,除18:0与20:0两种脂肪酸外,其他脂肪酸的游离态含量均显著高于结合态。这一结果与前人的研究结果相吻合[31]。造成这一现象的原因与脂肪酸在细胞中的生理功能有关。在植物细胞中,游离态脂肪酸与结合态脂肪酸在细胞中的分布与生理功能有一定的差异:前者主要位于细胞质中,作为细胞的储能物质为细胞提供能量或作为递质在细胞中传递信息; 而后者则主要分布在生物膜表面,起到支撑膜结构以及接收信息等功能。
在本实验中,共检测到了4种细菌脂肪酸,其结合态的初始含量均显著低于游离态。这些脂肪酸在未加菌组的浒苔样品中含量均较低,甚至无法检出,如18:1ω9。通常,浒苔表面以及原位海水中存在天然降解菌,因此可以检测到一定量的细菌脂肪酸。在培养前的抽滤过程中,大部分微生物被保留在海水当中,附着在浒苔表面的微生物含量较低,浒苔也没有开始吸附海水中的降解菌,因此实验初始阶段未加菌组细菌脂肪酸的含量较低。外源微生物的添加使这些脂肪酸在加菌组浒苔样品中的含量显著增加,浒苔表面吸附了更多的降解菌。这些实验结果与前期的研究结果一致。在张敏等人的实验中,在进行浒苔前处理时多次对其用蒸馏水漂洗,同样导致其中的细菌脂肪酸含量偏低,其中i-15:0 + a-15:0与17:0含量分别仅占脂肪酸总含量的0.21%与0.73%[32]。加入降解菌群后,这些脂肪酸的含量显著增高,表明外源微生物和浒苔表面携带的微生物有相似的脂肪酸组成。这种相似性表明加入培养体系的外源微生物没有改变该体系的微生物群落结构。实验开始后,加菌组浒苔吸附的部分微生物会进入海水中,导致细菌脂肪酸含量下降。在整个的实验过程中,加菌组培养体系细菌脂肪酸总含量始终显著高于未加菌组,表明加菌组的浒苔能够保持较高的细菌生物量,从而加速其降解。
4.2 不同浒苔脂类化合物的降解率
随着外源降解菌的引入,大多数浒苔脂类化合物的降解率均得到显著提升,提升幅度大多在10%−20%之间。这一结果表明外源降解菌的引入可有效促进脂类化合物的降解。这一结果与前人的微生物能对海洋中大分子有机物降解产生影响的相关研究结果吻合。例如在黎芯怡等人的研究中,使用筛选后得到降解菌可有效提升浒苔多糖的降解效率[33]。值得注意的是,17:0以及18:3两种脂肪酸的降解率在外源降解菌的作用下出现轻微的不升反降的现象,表明降解微生物在脂肪酸代谢过程中合成了此类脂肪酸。在培养的过程中,微生物除了降解浒苔中的脂类化合物,同时也在合成自身生存所必需的脂类,导致其特征脂肪酸的浓度上升。
浒苔游离态与结合态脂肪酸的降解率结果表明,结合态脂肪酸的降解率均显著高于游离态。这一结果与Ding等的研究结果相吻合[20]。在他们对海洋球石藻的脂肪酸降解研究中,结合态脂肪酸的降解率普遍高于游离态,例如脂肪酸16:0在好氧降解条件下其游离态与结合态的降解率分别为71.7%与80.4%。造成这种现象的原因,除了结合态脂肪酸本身降解率高于游离态外,主要与游离态与结合态间的相互转换有关。在浒苔降解过程中,其生物膜结构会首先受到破坏,导致结合态脂肪酸转化为游离态,使结合态脂肪酸不断降解,而游离态脂肪酸一边降解一边不断生成,导致其降解率较结合态偏低。
不同浒苔脂肪酸的降解率存在一定的差异:对于未加菌组浒苔而言,大部分脂肪酸的总降解速率普遍在70~80%,而部分不饱和脂肪酸总降解率处于50%水平(16:1ω7)。一般来说,脂肪酸的降解率应随着不饱和度的提升而增加。例如在随伟伟等人[31, 34]对微藻脂肪酸的降解研究中,16:1ω7的降解率在95%以上,而16:0的降解率则处于65~75%之间[34],与我们的研究结果有一定差别。在我们的实验体系中,不论是天然降解菌还是引入的外源降解菌,均由多种异养微生物组成,因而能够充分利用对不同浒苔脂肪酸,从而能够对它们进行无差别降解,消除了浒苔脂肪酸化学结构的差异对其降解率的影响。此外,对于部分脂肪酸,其含量随着培养的进行未发生显著变化甚至出现不降反升的现象,归因于降解菌在代谢过程中合成了新的脂肪酸;以及长链脂肪酸降解后生成了链长较短的脂肪酸。
对于细菌脂肪酸,其降解率在未加菌组与加菌组中呈现截然不同的状况:加菌组其降解率与其他脂肪酸水平相近,处于80%−90%之间,而未加菌组则普遍呈现几乎未降解或不降反增的趋势。未加菌组培养体系出现这一现象的原因,归于与培养体系中初始微生物丰度较低所致,个体间竞争关系相对较弱,随着浒苔的降解微生物生物量显著升高,合成细菌脂肪酸量高于消耗,故导致微生物脂肪酸含量在培养末期不降反增。
对浒苔中性脂而言,其未加菌组与加菌组的降解率分别处于30%与50%水平,显著低于脂肪酸。在两种条件下,植醇的降解率均高于28-异褐藻甾醇。通常来说,由于微生物对脂类化合物的选择性降解,中性脂的降解率通常低于脂肪酸,且在中性脂中,甾醇由于其结构稳定,导致其较难降解。例如在Sun等人对赫氏圆石藻降解研究的结果表明,在所有被测脂类化合物中,两种甾醇的降解率显著低于其他脂类化合物[35]。在真核藻类细胞中,甾醇是其细胞膜的重要成分,在调控膜结构的流动性、通透性、与膜结合酶的活性,以及物质运输等方面具有重要作用。与脂肪酸不同,细菌等原核生物中一般不含有甾醇,因此它们对甾醇的利用能力也较弱,导致其在培养体系的降解率低于脂肪酸。
4.3 不同浒苔脂类化合物的降解趋势与降解速率
浒苔各脂类化合物的总含量与结合态部分的含量随培养时间均呈现为先快速下降后缓慢下降的趋势,而它们的游离态部分,部分脂肪酸含量呈现先上升后下降的趋势或波动变化趋势,例如游离态的14:0与18:0,表明降解过程中浒苔结合态脂肪酸在不断向游离态转化。
为进一步分析各脂类化合物的降解过程,对在培养过程中呈下降趋势的脂类化合物的整个降解过程或者是其含量的下降阶段使用G-model进行模拟,结果如图3~6所示。进行模拟时,每种浒苔脂类化合物均被分成降解较快和较慢的两个部分,降解速率常数k1、k2根据何云红等[18]提供的方法计算,所得的浒苔脂类化合物降解速率常数如表3所示。通过G-model模拟计算获得的数据与实测数据的相关系数均在0.95以上,表明该模型能够很好的模拟浒苔脂肪酸在培养体系的降解过程。平均降解速率常数模拟计算的结果表明,随着外源降解菌的引入,大部分脂类化合物的降解速率常数有不同程度的提升,幅度在多在70%左右。但对于某些脂肪酸,其降解速率常数随着外源降解菌的引入并未显著提升,甚至出现下降。例如16:1ω7的总含量的平均降解速率随着降解菌的加入由4.35 d−1下降至1.84 d−1。这种趋势,一方面与微生物合成代谢和长链脂类化合物降解生成该脂肪酸有关,另一方面,可能与外源降解菌与培养体系原有的降解菌在降解浒苔过程中的竞争有关。培养体系引入外源降解菌后,与原有的降解菌发生竞争,导致某些脂类化合物在培养前期的降解速率下降。此外,16S rDNA测序的结果表明,厂家添加的布氏乳杆菌,酸鱼乳杆菌,菊糖芽孢乳杆菌,青春双歧杆菌等是微生物菌群扩繁过程中对菌群繁殖起支持和营养作用的微生物,不适合在海洋环境中生长繁殖。因此,在降解起始阶段,这些微生物完成对整个菌群的支持和营养作用之后,会因不适应海洋环境而死亡消失,而菌群中适应海洋环境的微生物会继续生长繁殖并促进浒苔的降解。这个过程也会导致在培养前期外源微生物菌群降解效率的下降。随着降解过程的进行,外源降解菌与原有的降解菌通过竞争完成了对降解环境的适应,降解速率也随之提升。通过对比各系列的k1与k2值可以发现,未加菌组中各系列的k1值往往大于加菌组,而k2值则普遍小于或接近加菌组。例如未加菌组结合态16:1ω7的k1值(6.27 d−1)大于加菌组(5.95 d−1),而k2值则在未加菌组(0.06 d−1)显著小于加菌组(0.41 d−1)。表明外源降解菌对k2也就是浒苔脂类化合物降解较慢的部分的促进作用更加显著。
表 3 培养体系不同浒苔脂类化合物的降解速率常数Table 3. Degradation rate constants of the different lipids in the Ulva prolifera under the cultivation system脂肪酸种类 未加菌组 加菌组 k1/(d−1) k2/(d−1) kav/(d−1) r2 k1/(d−1) k2/(d−1) kav/(d−1) r2 14:0 游离态 - - - - - - 结合态 2.17 0.02 1.89 0.96 4.71 0.03 4.20 0.99 总含量 1.00 0.01 0.65 0.98 1.64 0.02 1.19 0.98 16:0 游离态 2.12 0.02 1.18 0.95 0.28 0.06 0.19 0.94 结合态 4.13 0.02 3.34 0.95 4.88 0.00 4.07 0.98 总含量 2.71 0.02 2.63 0.96 4.16 0.02 2.64 0.98 16:1ω7 游离态 2.96 0.02 1.30 0.97 0.51 0.10 0.28 0.99 结合态 6.27 0.06 5.47 0.97 5.95 0.41 5.27 0.98 总含量 4.66 0.05 4.35 0.99 2.27 0.23 1.84 0.97 18:0 游离态 7.90 0.02 3.82 0.96 0.21 0.21 0.21 0.97 结合态 5.06 0.03 3.97 0.96 5.29 0.08 4.54 0.99 总含量 6.08 0.05 3.83 0.98 1.95 0.14 1.46 0.98 18:1ω7 游离态 2.84 0.02 1.10 0.95 0.13 0.13 0.13 0.96 结合态 4.86 0.03 3.99 0.96 4.92 0.00 3.88 0.98 总含量 3.55 0.03 1.27 0.93 3.46 0.04 2.07 0.98 18:3 游离态 5.00 0.02 3.97 0.99 3.66 0.06 2.74 0.97 结合态 3.06 0.03 2.15 0.96 2.27 0.00 1.93 0.98 总含量 3.23 0.01 0.98 0.99 2.32 0.04 2.06 0.99 20:0 游离态 - - - - - - - - 结合态 4.49 0.07 3.88 0.97 5.35 0.02 4.76 0.99 总含量 1.38 0.01 0.94 0.97 1.80 0.04 1.24 0.96 22:0 游离态 2.97 0.00 2.27 0.97 0.79 0.17 0.45 0.99 结合态 2.38 0.03 1.62 0.98 3.79 0.08 3.06 0.97 总含量 2.70 0.00 2.03 0.99 2,78 0.11 2.43 0.97 植醇 游离态 1.57 0.01 0.24 0.90 0.58 0.06 0.35 0.92 结合态 0.67 0.04 0.38 0.94 1.76 0.01 0.89 0.99 总含量 0.99 0.01 0.32 0.93 1.05 0.02 0.69 0.94 28-异褐
藻甾醇游离态 1.83 0.01 0.48 0.91 1.43 0.01 0.70 0.96 结合态 0.92 0.05 0.43 0.96 1.79 0.16 1.49 0.99 总含量 1.16 0.02 0.47 0.92 1.54 0.04 0.91 0.97 *:r2是G-模型模拟计算结果和实际实验结果的相关系数,下同。 对比游离态与结合态浒苔脂类化合物的降解过程,结果表明,多数游离态浒苔脂类化合物的降解速率均低于其结合态。例如,加菌组的18:0,其游离态与结合态的降解速率常数分别为0.21 d−1与4.54 d−1。这一结果与降解率的情况相吻合,同样与浒苔脂类由游离态向结合态转化有关。在本实验中,经过冷冻的浒苔丧失了新陈代谢能力,因此浒苔脂类由游离态向结合态转化是由降解微生物驱动的。对比各脂类化合物降解速率常数的结果表明,在未加菌组中,浒苔脂肪酸总含量的降解速率常数普遍在0.9 d−1 以上,而中性脂的降解速率常数则处于低于0.5 d−1 的水平。无论时候加菌组还是为加菌组,不饱和浒苔脂肪酸的不饱和度对其降解速率常数没有显著影响,进一步说明了降解菌能够对浒苔脂肪酸进行无差别降解,从而消除了脂类化合物结构差异对其降解速率的影响;而对中性脂而言,因为其难以被降解菌利用,它们的降解速率显著低于脂肪酸。外源微生物的添加,对浒苔中性脂降解速率的提升幅度显著高于浒苔脂肪酸,进一步证实外源微生物能够促进难降解浒苔脂类化合物的降解。此外,观察细菌脂肪酸在加菌组的降解情况可发现,该类脂肪酸总含量的降解速率相对其他加菌组脂类化合物偏高,可能是不同微生物的竞争所致。在降解初期,由于培养体系中微生物之间的竞争关系也相对激烈,同时加菌组浒苔吸附的一部分降解菌进入海水中,导致浒苔吸附的微生物的生物量出现一定程度的下降,进而使培养前期浒苔样品的细菌脂肪酸的含量快速降低,影响了降解菌对浒苔的快速降解。而在降解后期,随着不同微生物通过竞争达到平衡,细菌脂肪酸的含量也恢复至正常水平。
将各培养系列中各脂肪酸总含量与中性脂总含量的随时间的变化用G-model进行拟合,得到的降解曲线、降解率与降解速率常数如图10与表4所示。从总体上看,不论是游离态的脂类化合物,还是结合态的脂类化合物,均呈现出先快速下降后缓慢下降的趋势。没有外源微生物的培养体系,k2均较低,甚至接近于0, 意味着培养体系原有的降解菌对部分浒苔脂类化合物降解困难;随着外源微生物的加入,k2大幅度提高,表明外源微生物的加入显著促进了浒苔脂类化合物难降解部分的降解,这种促进作用是提升浒苔脂类化合物降解的关键,进一步表明向海水中添加外源微生物降解菌群有助于加快海洋环境浒苔的降解。
 图 10 浒苔脂肪酸与中性脂中游离态部分、结合态部分含量以及它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得Figure 10. Time-dependent variations profiles of the contents of the free and bound fractions of the fatty acids and the neutral lipids and their respective total contents in the Ulva prolifera. In the panels, the points represent measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets表 4 浒苔总脂肪酸与总中性脂的降解速率常数与降解率Table 4. Degradation rate constants and degradation efficiencies of the total fatty acids and the total neutral lipids in the Ulva prolifera
图 10 浒苔脂肪酸与中性脂中游离态部分、结合态部分含量以及它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得Figure 10. Time-dependent variations profiles of the contents of the free and bound fractions of the fatty acids and the neutral lipids and their respective total contents in the Ulva prolifera. In the panels, the points represent measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets表 4 浒苔总脂肪酸与总中性脂的降解速率常数与降解率Table 4. Degradation rate constants and degradation efficiencies of the total fatty acids and the total neutral lipids in the Ulva prolifera化合物种类 未加菌组 加菌组 k1/
(d−1)k2/
(d−1)kav/
(d−1)r2 降解
率/%k1/
(d−1)k2/
(d−1)kav/
(d−1)r2 降解
率/%脂肪酸 游离态 1.60 0.01 0.91 0.97 58.1 0.14 0.14 0.14 0.98 90.8 结合态 2.97 0.02 0.65 0.96 83.9 2.73 0.05 0.44 0.99 89.0 总含量 2.63 0.01 0.55 0.98 67.2 1.43 0.08 0.90 0.98 90.2 中性脂 游离态 1.79 0 0.47 0.96 41.1 1.79 0.02 0.75 0.95 50.9 结合态 0.35 0.03 0.10 0.98 43.0 0.45 0.06 0.34 0.99 92.8 总含量 2.63 0.01 0.55 0.95 41.3 2.28 0.03 0.95 0.96 53.7 5. 结论
本研究的结果表明,在海水体系中,浒苔中性脂降解速率整体上低于浒苔脂肪酸,结合态脂类化合物的降解速率与降解率均高于游离态。向海水体系引入外源降解菌群的能够有效促进浒苔沉降,并显著提升浒苔脂肪酸与中性脂的降解率与降解速率。向海水中加入外源降解菌群使浒苔脂肪酸的降解率提升了10~20%,中性脂降解率从30%提升至50%;大多数浒苔脂肪酸的降解速率提升了约70%,中性脂的降解速率提升了约90%。外源微生物菌群能够无差别的利用浒苔脂肪酸,使不同不饱和度浒苔脂肪酸在海水中的降解速率没有显著差别。
本研究为应用微生物技术在天然环境治理浒苔绿潮提供理论支持,表明利用微生物菌群的降解作用应对浒苔爆发,有潜力成为一种解决浒苔绿潮问题的有效手段,也为应用微生物技术解决海洋环境问题提供了新的思路。
-
图 6 浒苔各饱和脂肪酸中游离态部分含量、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得
Fig. 6 Time-dependent variations profiles of the contents of free, bound, and total saturated fatty acids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets
图 7 浒苔各不饱和脂肪酸中游离态部分含量、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得。
Fig. 7 Time-dependent variations profiles of the contents of free, bound, and total unsaturated fatty acids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets.
图 8 浒苔细菌脂肪酸中游游离态部分含量、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得。
Fig. 8 Time-dependent variations profiles of the contents of free, bound, and total bacterial fatty acids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets.
图 9 浒苔各中性脂中游离态部分、结合态部分含量与它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得
Fig. 9 Time-dependent variations profiles of the contents of free, bound, and total neutral lipids in the Ulva prolifera. In the panels, the points represent the measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets
图 10 浒苔脂肪酸与中性脂中游离态部分、结合态部分含量以及它们的总含量随培养时间变化情况。图中的点为实测结果,曲线为G-model模拟结果。初始值为两组数据实际初始值的平均值,误差棒根据这两组数据计算获得
Fig. 10 Time-dependent variations profiles of the contents of the free and bound fractions of the fatty acids and the neutral lipids and their respective total contents in the Ulva prolifera. In the panels, the points represent measured results, and the curves represent the G-model simulation results. The initial value is the average of the actual initial values from the two datasets, and the error bars are calculated based on these two datasets
表 1 不同浒苔脂肪酸的降解率(降解率为负值表明含量增加)
Tab. 1 Degradation efficiencies of different fatty acids in the Ulva prolifera (negative degradation efficiencies indicate an increase in the content)
脂肪酸种类 未加菌组降解率/% 加菌组降解率/% 14:0 游离态 40.2 89.1 结合态 86.9 93.5 总含量 70.5 90.6 16:0 游离态 64.0 91.6 结合态 84.6 92.9 总含量 70.0 91.9 16:1ω7 游离态 42.8 92.3 结合态 99.9 93.9 总含量 53.8 92.7 18:0 游离态 38.2 91.7 结合态 85.6 94.2 总含量 81.7 92.1 18:1ω7 游离态 52.6 78.9 结合态 87.5 80.8 总含量 68.3 79.1 18:3 游离态 79.5 87.6 结合态 82.9 84.9 总含量 79.7 86.9 20:0 游离态 −25.5 −20.7 结合态 94.2 91.3 总含量 71.3 80.1 22:0 游离态 77.2 92.7 结合态 77.8 92.3 总含量 77.6 92.6 表 2 两种浒苔中性脂的降解率
Tab. 2 Degradation efficiencies of the two types of the neutral lipids in the Ulva prolifera
脂肪酸种类 未加菌组降解率/% 加菌组降解率/% 植醇 游离态 32.8 52.1 结合态 21.1 78.3 总含量 31.1 58.6 28-异褐藻
甾醇游离态 33.8 55.4 结合态 69.8 97.2 总含量 31.6 62.3 表 3 培养体系不同浒苔脂类化合物的降解速率常数
Tab. 3 Degradation rate constants of the different lipids in the Ulva prolifera under the cultivation system
脂肪酸种类 未加菌组 加菌组 k1/(d−1) k2/(d−1) kav/(d−1) r2 k1/(d−1) k2/(d−1) kav/(d−1) r2 14:0 游离态 - - - - - - 结合态 2.17 0.02 1.89 0.96 4.71 0.03 4.20 0.99 总含量 1.00 0.01 0.65 0.98 1.64 0.02 1.19 0.98 16:0 游离态 2.12 0.02 1.18 0.95 0.28 0.06 0.19 0.94 结合态 4.13 0.02 3.34 0.95 4.88 0.00 4.07 0.98 总含量 2.71 0.02 2.63 0.96 4.16 0.02 2.64 0.98 16:1ω7 游离态 2.96 0.02 1.30 0.97 0.51 0.10 0.28 0.99 结合态 6.27 0.06 5.47 0.97 5.95 0.41 5.27 0.98 总含量 4.66 0.05 4.35 0.99 2.27 0.23 1.84 0.97 18:0 游离态 7.90 0.02 3.82 0.96 0.21 0.21 0.21 0.97 结合态 5.06 0.03 3.97 0.96 5.29 0.08 4.54 0.99 总含量 6.08 0.05 3.83 0.98 1.95 0.14 1.46 0.98 18:1ω7 游离态 2.84 0.02 1.10 0.95 0.13 0.13 0.13 0.96 结合态 4.86 0.03 3.99 0.96 4.92 0.00 3.88 0.98 总含量 3.55 0.03 1.27 0.93 3.46 0.04 2.07 0.98 18:3 游离态 5.00 0.02 3.97 0.99 3.66 0.06 2.74 0.97 结合态 3.06 0.03 2.15 0.96 2.27 0.00 1.93 0.98 总含量 3.23 0.01 0.98 0.99 2.32 0.04 2.06 0.99 20:0 游离态 - - - - - - - - 结合态 4.49 0.07 3.88 0.97 5.35 0.02 4.76 0.99 总含量 1.38 0.01 0.94 0.97 1.80 0.04 1.24 0.96 22:0 游离态 2.97 0.00 2.27 0.97 0.79 0.17 0.45 0.99 结合态 2.38 0.03 1.62 0.98 3.79 0.08 3.06 0.97 总含量 2.70 0.00 2.03 0.99 2,78 0.11 2.43 0.97 植醇 游离态 1.57 0.01 0.24 0.90 0.58 0.06 0.35 0.92 结合态 0.67 0.04 0.38 0.94 1.76 0.01 0.89 0.99 总含量 0.99 0.01 0.32 0.93 1.05 0.02 0.69 0.94 28-异褐
藻甾醇游离态 1.83 0.01 0.48 0.91 1.43 0.01 0.70 0.96 结合态 0.92 0.05 0.43 0.96 1.79 0.16 1.49 0.99 总含量 1.16 0.02 0.47 0.92 1.54 0.04 0.91 0.97 *:r2是G-模型模拟计算结果和实际实验结果的相关系数,下同。 表 4 浒苔总脂肪酸与总中性脂的降解速率常数与降解率
Tab. 4 Degradation rate constants and degradation efficiencies of the total fatty acids and the total neutral lipids in the Ulva prolifera
化合物种类 未加菌组 加菌组 k1/
(d−1)k2/
(d−1)kav/
(d−1)r2 降解
率/%k1/
(d−1)k2/
(d−1)kav/
(d−1)r2 降解
率/%脂肪酸 游离态 1.60 0.01 0.91 0.97 58.1 0.14 0.14 0.14 0.98 90.8 结合态 2.97 0.02 0.65 0.96 83.9 2.73 0.05 0.44 0.99 89.0 总含量 2.63 0.01 0.55 0.98 67.2 1.43 0.08 0.90 0.98 90.2 中性脂 游离态 1.79 0 0.47 0.96 41.1 1.79 0.02 0.75 0.95 50.9 结合态 0.35 0.03 0.10 0.98 43.0 0.45 0.06 0.34 0.99 92.8 总含量 2.63 0.01 0.55 0.95 41.3 2.28 0.03 0.95 0.96 53.7 -
[1] 王建伟, 阎斌伦, 林阿朋, 等. 浒苔(Enteromorpha prolifera)生长及孢子释放的生态因子研究[J]. 海洋通报, 2007, 26(2): 60−65.Wang Jianwei, Yan Binlun, Lin Apeng, et al. Ecological factor research on the growth and induction of spores release in Enteromorpha Prolifera (Chlorophyta)[J]. Marine Science Bulletin, 2007, 26(2): 60−65. [2] Zheng Longxiao, Wu Mengquan, Zhao Jie, et al. Effects of Ulva prolifera dissipation on the offshore environment based on remote sensing images and field monitoring data[J]. Acta Oceanologica Sinica, 2023, 42(6): 112−120. doi: 10.1007/s13131-022-2129-7 [3] Fan Qingxin, Shi Kunpeng, Zhan Min, et al. Acute damage from the degradation of Ulva prolifera on the environmental microbiota, intestinal microbiota and transcriptome of Japanese flounder Paralichthys olivaceus[J]. Environmental Pollution, 2022, 302: 119022. doi: 10.1016/j.envpol.2022.119022 [4] 颜天, 于仁成, 周名江, 等. 黄海海域大规模绿潮成因与应对策略——“鳌山计划”研究进展[J]. 海洋与湖沼, 2018, 49(5): 950−958. doi: 10.11693/hyhz20180700156Yan Tian, Yu Rencheng, Zhou Mingjiang, et al. Mechanism of massive formation and prevention strategy against large-scale green tides in the south yellow sea[J]. Oceanologia et Limnologia Sinica, 2018, 49(5): 950−958. doi: 10.11693/hyhz20180700156 [5] Dong Shuhang, Xin Yu, Liu Chunying, et al. Two treatment methods on Ulva prolifera bloom result in distinctively different ecological effects in coastal environment[J]. Frontiers in Marine Science, 2023, 10: 1084519. doi: 10.3389/fmars.2023.1084519 [6] 王宗灵, 傅明珠, 肖洁, 等. 黄海浒苔绿潮研究进展[J]. 海洋学报, 2018, 40(2): 1−13.Wang Zongling, Fu Mingzhu, Xiao Jie, et al. Progress on the study of the Yellow Sea green tides caused by Ulva prolifera[J]. Haiyang Xuebao, 2018, 40(2): 1−13. [7] Xia Zhangyi, Yuan Huanqing, Liu Jinlin, et al. A review of physical, chemical, and biological green tide prevention methods in the Southern Yellow Sea[J]. Marine Pollution Bulletin, 2022, 180: 113772. doi: 10.1016/j.marpolbul.2022.113772 [8] 朱强, 夏艳秋, 顾冬莹, 等. 浒苔降解菌分离筛选与鉴定[J]. 安徽农业科学, 2017, 45(32): 152−155.Zhu Qiang, Xia Yanqiu, Gu Dongying, et al. Isolation, screening and identification of Enteromorpha prolifera degrading bacterial strain[J]. Journal of Anhui Agricultural Sciences, 2017, 45(32): 152−155. [9] 谢罗瀚, 韩学凤, 张志标, 等. 源自黄斑篮子鱼肠道菌群的B30菌株降解浒苔多糖的活性研究[J]. 韩山师范学院学报, 2016, 37(6): 49−55.Xie Luohan, Han Xuefeng, Zhang Zhibiao, et al. A study of Enteromorpha polysaccharides-degraded ability of strain B30 from Siganus Oramin intestina[J]. Journal of Hanshan Normal University, 2016, 37(6): 49−55. [10] 宁利敏, 姚忠, 朱本伟, 等. 浒苔多糖的结构、制备与降解研究进展[J]. 现代食品科技, 2022, 38(6): 343−353.Ning Limin, Yao Zhong, Zhu Benwei, et al. Research progress on the structure, preparation and degradation of Enteromorpha polysaccharides[J]. Modern Food Science and Technology, 2022, 38(6): 343−353. [11] Hebbale D, Bhargavi R, Ramachandra T V. Saccharification of macroalgal polysaccharides through prioritized cellulase producing bacteria[J]. Heliyon, 2019, 5(3): e01372. doi: 10.1016/j.heliyon.2019.e01372 [12] Li Yinping, Cui Jiefen, Zhang Gaoli, et al. Optimization study on the hydrogen peroxide pretreatment and production of bioethanol from seaweed Ulva prolifera biomass[J]. Bioresource Technology, 2016, 214: 144−149. doi: 10.1016/j.biortech.2016.04.090 [13] Li Bing, Liu Song, Xing Ronge, et al. Degradation of sulfated polysaccharides from Enteromorpha prolifera and their antioxidant activities[J]. Carbohydrate Polymers, 2013, 92(2): 1991−1996. doi: 10.1016/j.carbpol.2012.11.088 [14] Ischebeck T, Krawczyk H E, Mullen R T, et al. Lipid droplets in plants and algae: distribution, formation, turnover and function[J]. Seminars in Cell & Developmental Biology, 2020, 108: 82−93. [15] Gosch B J, Magnusson M, Paul N A, et al. Total lipid and fatty acid composition of seaweeds for the selection of species for oil-based biofuel and bioproducts[J]. GCB Bioenergy, 2012, 4(6): 919−930. doi: 10.1111/j.1757-1707.2012.01175.x [16] El-Fatah Abomohra A, El-Naggar A H, Baeshen A A. Potential of macroalgae for biodiesel production: screening and evaluation studies[J]. Journal of Bioscience and Bioengineering, 2018, 125(2): 231−237. doi: 10.1016/j.jbiosc.2017.08.020 [17] Nobles Jr D R, Manning S R. Extraction and characterization of lipids from macroalgae[J]. Methods in Molecular Biology, 2019, 1995: 131−140. [18] He Yunhong, Sun Chengjun, Li Wenjuan, et al. Degradation of lipids in seasonal hypoxic seawater under different oxygen saturation[J]. Journal of Oceanology and Limnology, 2018, 36(5): 1570−1585. doi: 10.1007/s00343-018-7110-0 [19] Geng Huixia, Yu Rencheng, Chen Zhenfan, et al. Analysis of sterols in selected bloom-forming algae in China[J]. Harmful Algae, 2017, 66: 29−39. doi: 10.1016/j.hal.2017.04.008 [20] Ding Haibing, Sun Mingyi. Biochemical degradation of algal fatty acids in oxic and anoxic sediment-seawater interface systems: effects of structural association and relative roles of aerobic and anaerobic bacteria[J]. Marine Chemistry, 2005, 93(1): 1−19. doi: 10.1016/j.marchem.2004.04.004 [21] 耿慧霞, 于仁成, 颜天, 等. 应用甾醇类生物标志物追踪绿潮后期漂浮绿藻沉降区的方法[J]. 海洋与湖沼, 2018, 49(5): 1094−1102.Geng Huixia, Yu Rencheng, Yan Tian, et al. Using sterol biomarkers to trace deposition areas of floating green algae after green tides[J]. Oceanologia et Limnologia Sinica, 2018, 49(5): 1094−1102. [22] 刘英霞, 常显波, 王桂云, 等. 浒苔的危害及防治[J]. 安徽农业科学, 2009, 37(20): 9566−9567.Liu Yingxia, Chang Xianbo, Wang Guiyun, et al. Harm and prevention of Entermorpha prolifera[J]. Journal of Anhui Agricultural Sciences, 2009, 37(20): 9566−9567. [23] 彭全材, 宋金明, 张全斌, 等. 四种绿藻和四种褐藻脂肪酸组成的比较研究[J]. 海洋科学, 2014, 38(4): 27−33. doi: 10.11759/hykx20130530003Peng Quancai, Song Jinming, Zhang Quanbin, et al. Comparison of fatty acid compositions of four green algae and four brown algae[J]. Marine Sciences, 2014, 38(4): 27−33. doi: 10.11759/hykx20130530003 [24] He Yunhong, Sun Chengjun, Li Wenjuan, et al. Degradation of lipids in seasonal hypoxic seawater under different oxygen saturation[J]. Journal of Oceanology and Limnology, 2018, 36(5): 1570−1585. (查阅网上资料, 本条文献与第18条文献重复, 请确认) [25] Sun Mingyi, Wakeham S G, Lee C. Rates and mechanisms of fatty acid degradation in oxic and anoxic coastal marine sediments of Long Island Sound, New York, USA[J]. Geochimica et Cosmochimica Acta, 1997, 61(2): 341−355. doi: 10.1016/S0016-7037(96)00315-8 [26] Qu Tongfei, Zhao Xinyu, Hao Ya, et al. Ecological effects of Ulva prolifera green tide on bacterial community structure in Qingdao offshore environment[J]. Chemosphere, 2020, 244: 125477. doi: 10.1016/j.chemosphere.2019.125477 [27] Sun Mingyi, Shi Wei, Lee R F. Lipid-degrading enzyme activities associated with distribution and degradation of fatty acids in the mixing zone of Altamaha estuarine sediments[J]. Organic Geochemistry, 2000, 31(9): 889−902. doi: 10.1016/S0146-6380(00)00051-6 [28] Harvey H R, Tuttle J H, Bell J T. Kinetics of phytoplankton decay during simulated sedimentation: changes in biochemical composition and microbial activity under oxic and anoxic conditions[J]. Geochimica et Cosmochimica Acta, 1995, 59(16): 3367−3377. doi: 10.1016/0016-7037(95)00217-N [29] 尹琳琳, 杨佰娟, 郑立, 等. 浒苔脂肪酸前处理方法优化及GC/MS分析[J]. 海洋科学, 2010, 34(11): 46−50.Yin Linlin, Yang Baijuan, Zheng Li, et al. Optimization and analyzation of fatty acids pre-treatment of Enteromorpha prolifera by GC/MS[J]. Marine Sciences, 2010, 34(11): 46−50. [30] Generalić Mekinić I, Čagalj M, Tabanelli G, et al. Seasonal changes in essential oil constituents of Cystoseira compressa: first report[J]. Molecules, 2021, 26(21): 6649. doi: 10.3390/molecules26216649 [31] 随伟伟. 微藻生物标志物在季节性缺氧环境海水—沉积物界面降解的模拟研究[D]. 青岛: 中国海洋大学, 2013.Sui Weiwei. Simulation of microalgae biomarkers degradation in sediment-seawater interface in seasonal hypoxia environments[D]. Qingdao: Ocean University of China, 2013. [32] 张敏, 李瑞霞, 伊纪峰, 等. 4种经济海藻脂肪酸组成分析[J]. 海洋科学, 2012, 36(4): 7−12.Zhang Min, Li Ruixia, Yi Jifeng, et al. Analysis of the fatty acid composition of four economic seaweeds[J]. Marine Sciences, 2012, 36(4): 7−12. [33] 黎芯怡, 王静涵, 甄莉, 等. 浒苔多糖降解菌的筛选及其碳源利用谱分析[J]. 广西科技大学学报, 2023, 34(3): 123−131.Li Xinyi, Wang Jinghan, Zhen Li, et al. Screening of Ulva prolifera polysaccharide-degrading bacteria and analysis of its carbon source utilization spectrum[J]. Journal of Guangxi University of Science and Technology, 2023, 34(3): 123−131. [34] 随伟伟, 丁海兵, 杨桂朋, 等. 微藻脂肪酸在中国近海缺氧海水-沉积物界面中的降解模拟研究[J]. 环境科学, 2013, 34(11): 4231−4239.Sui Weiwei, Ding Haibing, Yang Guipeng, et al. Simulated study of algal fatty acid degradation in hypoxia seawater-sediment interface along China Coastal Area[J]. Environmental Science, 2013, 34(11): 4231−4239. [35] Sun Mingyi, Zou Li, Dai Jihong, et al. Molecular carbon isotopic fractionation of algal lipids during decomposition in natural oxic and anoxic seawaters[J]. Organic Geochemistry, 2004, 35(8): 895−908. doi: 10.1016/j.orggeochem.2004.04.001 [36] 王东亮, 姜炜, 李峰. 浒苔绿潮对海洋水环境的影响分析——以2020年海阳浒苔绿潮水环境监测分析为例[J]. 鲁东大学学报(自然科学版), 2021, 37(4): 374−378, 384.Wang Dongliang, Jiang Wei, Li Feng. Influence of Enteromorpha prolifera green tide on marine water environment: taking the environmental monitoring and analysis of Enteromorpha prolifera green tide in Haiyang in 2020 as an example[J]. Journal of Ludong University (Natural Science Edition), 2021, 37(4): 374−378, 384. [37] 苑克磊, 侯查伟, 丁一, 等. 我国黄海浒苔绿潮暴发海域环境因子季节性变化及年际变化分析[J]. 广西科学院学报, 2018, 34(3): 204−209. [38] Yuan Kelei, Hou Chawei, Ding Yi, et al. Analysis of the seasonal and inter-annual changes of environmental factors in Enteromorpha prolifera green tide outbreak in the Yellow Sea[J]. Journal of Guangxi Academy of Sciences, 2018, 34(3): 204−209. (查阅网上资料, 本条文献为第38条文献的英文翻译信息, 请确认) -





 下载:
下载:
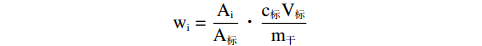
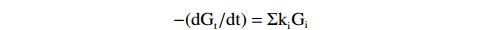
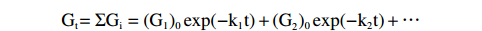
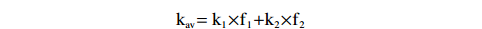





 下载:
下载: