Changes of scleractinian coral communities in the Daya Bay in the last 40 years
-
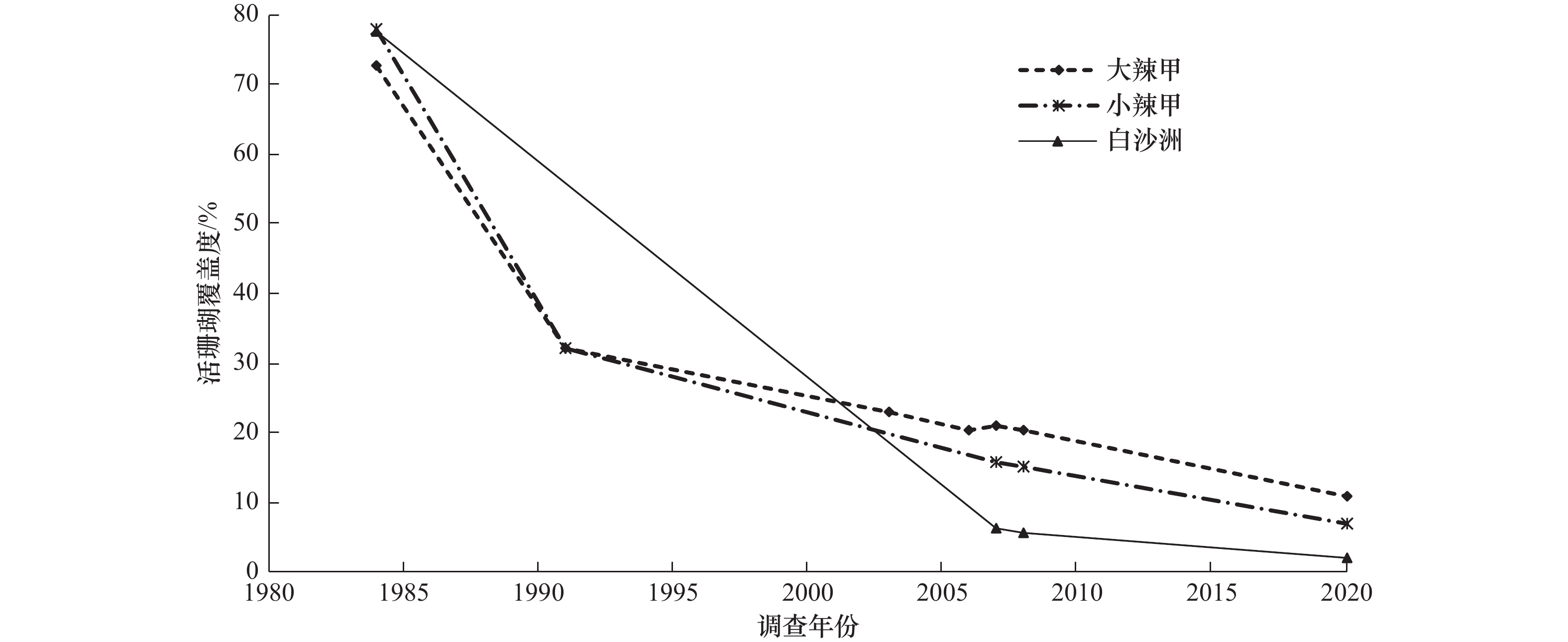
摘要: 本研究采用文献调研、现场调查和室内模拟试验等方法对大亚湾造礁石珊瑚的种群结构演变及其成因进行了探讨。2020年7月现场调查共发现造礁石珊瑚39种,块状的扁脑(Platygyra)、蜂巢(Favia)和角蜂巢(Favites)等是湾内优势珊瑚。1983/1984−2020年,大亚湾珊瑚群落演变的主要特征是曾经优势的鹿角珊瑚(Acropora)和蔷薇珊瑚(Montipora)从湾内基本消失。综合全球珊瑚礁退化大背景和大亚湾独特的水环境分析发现:大亚湾珊瑚群落退化是多方面因素共同作用的结果,其中珊瑚本身的脆弱性和环境中持续的夏季异常高温与低溶解氧含量的共同作用可能是湾内霜鹿角珊瑚(A. pruinosa)退化的主要原因。从湾内珊瑚群落恢复的种源考量,建议加强对刷洲东岛珊瑚群落的保护。Abstract: In order to disclose the changes of coral communities in the Daya Bay, literature analysis, field investigation and laboratory simulating experiments were performed. A total of 39 scleractinian coral species were detected in the 2020 field investigation, and massive coral Platygyra, Favia and Favites were dominant in the bay. The inlet coral community change was featured by the near completely lost of once dominant coral Acropora and Montipora during 1983/1984−2020. Analysis based on the background of global coral degradation and the specialty of the seawater environment in the Daya Bay indicated that the coral community degradation in the Daya Bay is a result of multiple stressors, and the susceptibility of Acropora and the frequent occurrence of high temperature and low content oxygen may be the main cause of inlet A. pruinosa lost. At last, as a potential larva source of inlet coral restoration, coral community of Shuazhou East Island should be protected seriously.
-
Key words:
- Daya Bay /
- scleractinian coral /
- community change /
- high temperature /
- low dissolved oxygen
-
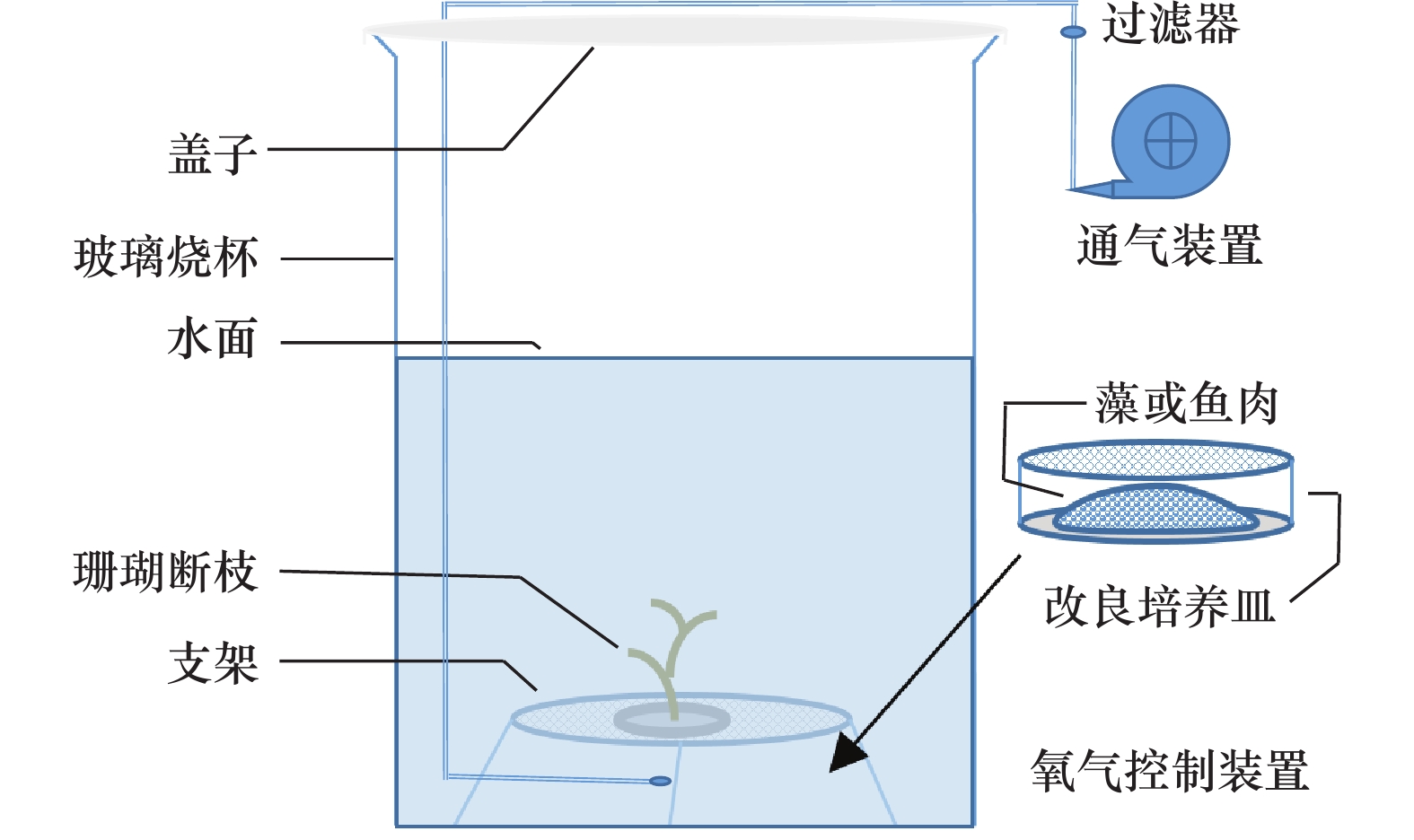
图 3 珊瑚模拟试验装置示意图
自然降氧试验条件:陈海水,放入氧气控制装置,关闭通气,自然光,室温;低盐度胁迫试验:培养体系为低盐度的海水,通气,自然光,室温;沉积物悬浮胁迫试验:陈海水,加入沉积物,自然通气,自然光,室温
Fig. 3 Schematic diagram of the coral stress experiment set-up
Natural oxygen reduction test condition: old seawater, add the oxygen control set-up, close ventilation, natural light, room temperature; low salinity stress test: low salinity seawater, ventilation, natural light, room temperature; sediments suspension stress test: old seawater, add sediment, natural ventilation, natural light, room temperature
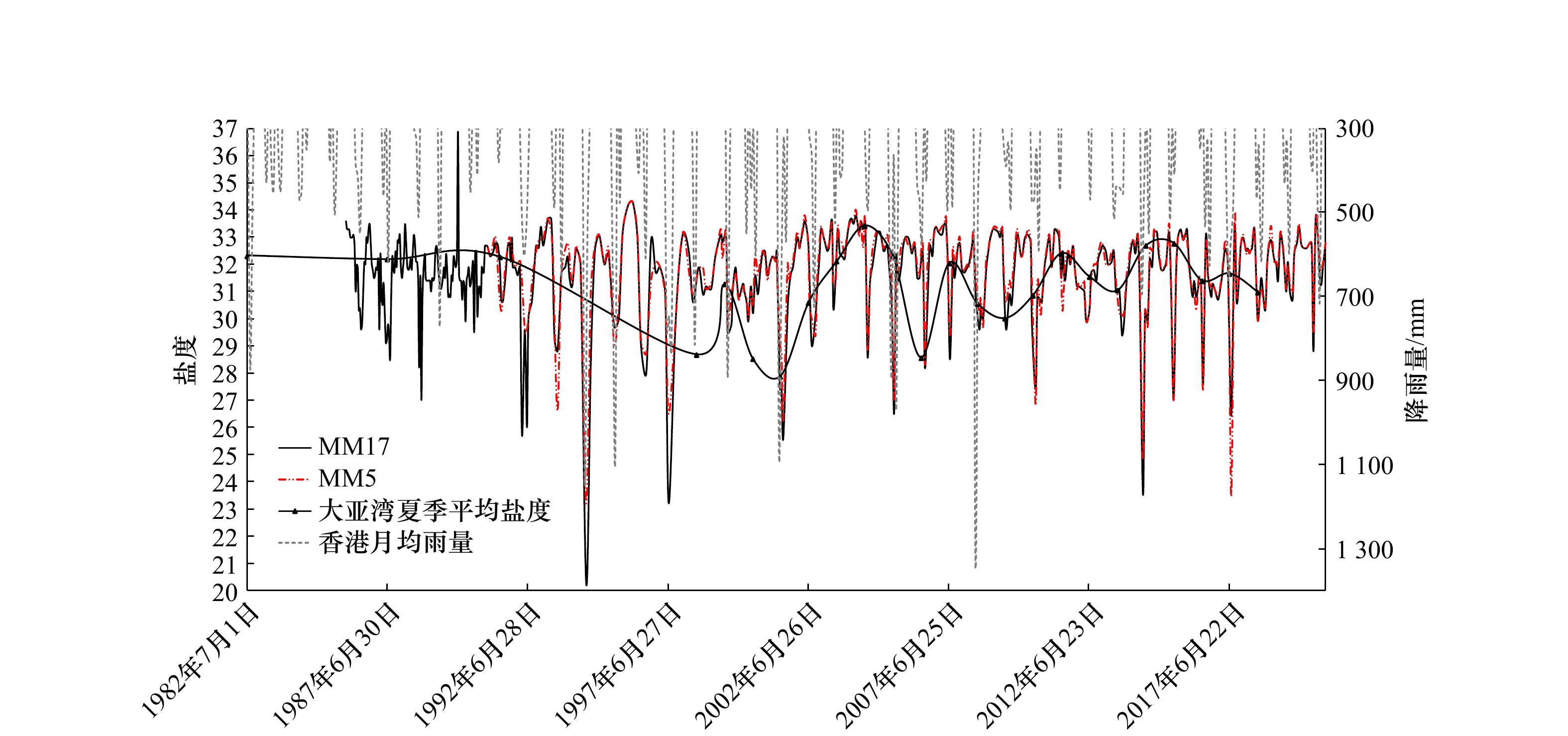
图 5 2021年07月29日至8月1日大亚湾温度、盐度、溶解氧含量和叶绿素含量垂直分布
SM. 三门岛;D. 大辣甲;X. 小辣甲;B. 白沙洲;S. 南部;S2. 南部第二站位;N. 北部;图例后面的数字代表CTD记录号
Fig. 5 The vertical distribution of seawater temperature, salinity, dissolved oxygen content and chlorophyll content of theDaya Bay from July 29 to August 1, 2021
SM. Sanmen Island; D. Dalajia; X. Xiaolajia; B. Baishazhou; S. south; S2. south second station; N. north; the number after the legend represents the CTD record number
图 6 大亚湾鹿角珊瑚分布在相对较深的位置
a. 大辣甲刷洲东岛北面;b. 三门岛小横洲北面;c−f. 大辣甲西侧;d−f. 水深略浅,其珊瑚颜色较其他站位要淡很多;红色箭头指示鹿角珊瑚;a−c、f显示鹿角珊瑚生长位置相对较深
Fig. 6 The relative low lying niches of Acropora in the Daya Bay
a. North of East Island of Shuazhou, Dalajia; b. north of Xiaohengzhou, Sanmen Island; c−f. west of Dalajia; d−f. the seawater is low, and the coral color is a little pale; the red arrows indicated Acropoa; a−c, f. indicated coral live in relative low lying niches
图 8 高温低溶解氧含量胁迫下鹿角珊瑚和滨珊瑚的病症变化
a−c. 鹿角珊瑚在31°C和3 mg/L溶解氧作用下白化症状随时间的变化。a. 试验起始阶段;b. 60 h时远离生长点部位开始白化,箭头指示起始白化位点;c. 69 h时整株珊瑚白化,组织脱落,死亡。d−f. 滨珊瑚在32°C和4 mg/L溶解氧作用下白化症状随时间变化。d. 试验起始阶段;e. 胁迫70 h,箭头指示珊瑚斑块状白化;f. 胁迫70 h后解除胁迫,珊瑚慢慢恢复了生长,该图为6个月后拍摄
Fig. 8 The symptom change of Acropora and Porites under high temperature and low dissolved oxygen content
a−c. Acropora under 31°C and 3 mg/L dissolved oxygen. a. The start of the experiment; b. polyps far from growing point began bleaching after 60 h of stressindicated the initial bleaching site; c. the whole coral branch bleached, tissue lost and dead after 69 h of stress. d−f. Temporal symptoms of Porites under 32°C and 4 mg/L dissolved oxygen. d. The start of the experiment; e. patchy bleaching happened after 70 h of stress, arrows indicated different patches; f. stress was removed after 70 h, then Porites restored its growth, photo was took 6 month after the stress
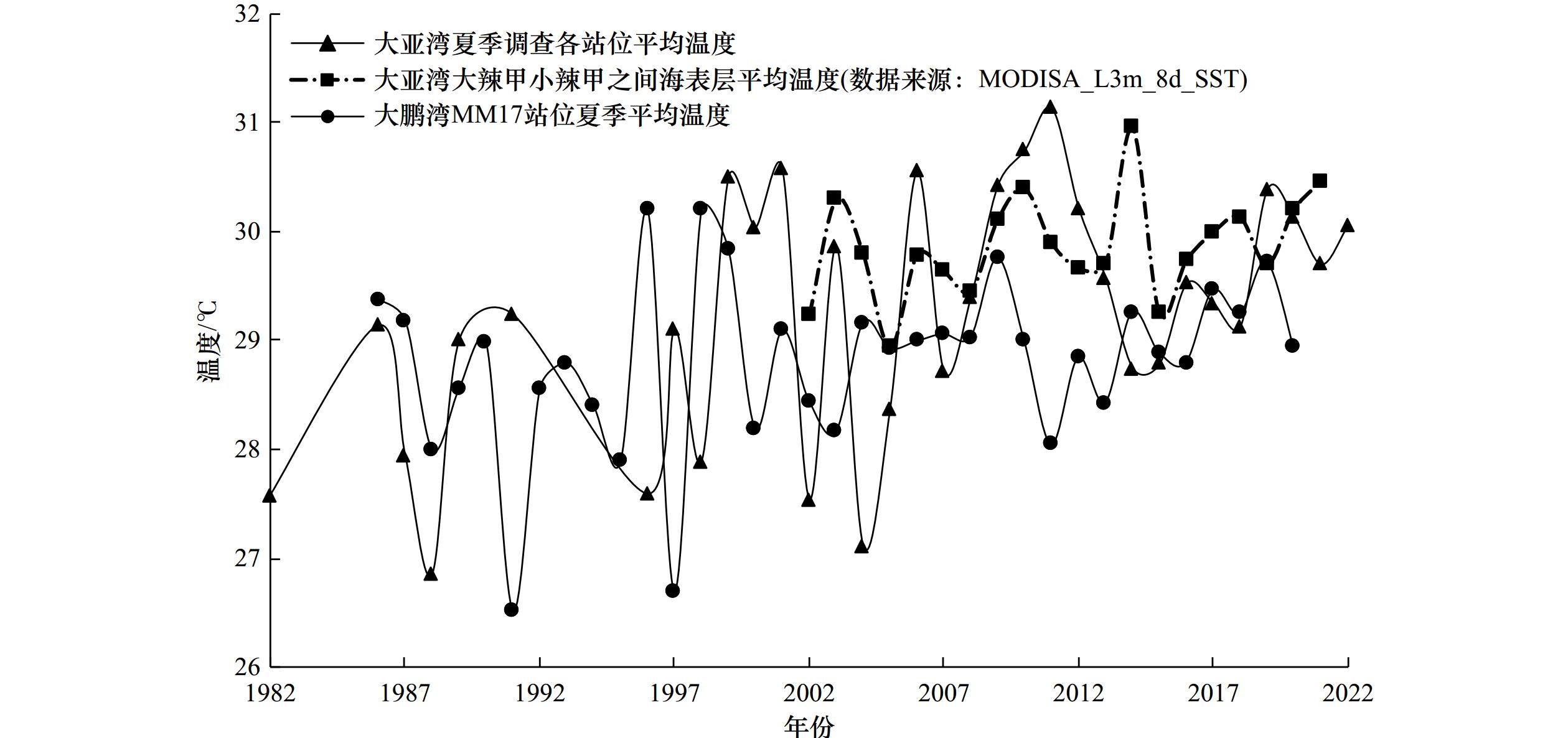
图 10 小辣甲滨珊瑚骨骼(采自4 m水深)年最低Sr/Ca和遮浪站年最高月均表层海水温度(多年平均温度28.2°C)距平(数据源于文献[24])
Fig. 10 Departure of the annual minimum Sr/Ca of Porites skeleton collected from 4 m depth of the Xiaolajia Island, and the annual maximum monthly average sea surface temperature (the multi-year average is 28.2°C) recorded in Zhelang Station (the date are frm reference [24])
A1 2020年7月大亚湾珊瑚群落调查单样线(50 m)最高活珊瑚覆盖度(%)
A1 The maximum live coral cover (%) in a single 50 m transect during the investigation of July 2020
序号 珊瑚种类 白沙洲 小辣甲 大辣甲 三门岛 1 翼形蔷薇珊瑚Montipora peltiformis (Bernard, 1897) − 0.2 1.6 8.8 2 平展蔷薇珊瑚Montipora solanderi (Bernard,1897) − − − 6.4 3 霜鹿角珊瑚Acropora pruinosa (Brook, 1893) − + + 0.4 4 指形鹿角珊瑚Acropora digitifera (Dana, 1846) − − + 0.6 5 单独鹿角珊瑚Acropora solitaryensis (Veron and Wallace, 1984) − − + 3.2 6 罩柱群珊瑚Stylocoeniella guentheri (Bassett-Smith, 1890) − 0.4 − − 7 丛生盔形珊瑚Galaxea fascicularis (Linnaeus, 1767) − 0.4 − 0.2 8 浅薄沙珊瑚Psammocora superficialis (Gardiner, 1898) − 2.4 0.2 − 9 毗邻沙珊瑚Psammocora contigua (Esper, 1794) − 0.2 − − 10 十字牡丹珊瑚Pavona decussata (Dana, 1846) − 0.2 0.2 0.2 11 腐蚀刺柄珊瑚Hydnophora exesa (Pallas, 1766) 0.2 − − 0.2 12 盾形陀螺珊瑚Turbinaria peltata (Esper, 1794) − − 2.6 − 13 罗图马蜂巢珊瑚Favia rotumana (Gardiner, 1899) 0.2 0.8 1.2 1.4 14 标准蜂巢珊瑚Favia speciosa (Dana, 1846) 0.2 0.6 1.4 1.6 15 美龙氏蜂巢珊瑚Favia veroni (Moll and Borel-Best, 1984) − 0.2 1 − 16 圆纹蜂巢珊瑚Favia pallida (Dana, 1846) − − − 0.4 17 海洋蜂巢珊瑚Favia maritima (Nemenzo, 1971) − − − 0.4 18 秘密角蜂巢珊瑚Favites abdita (Ellis and Solander, 1786) 0.6 2.2 0.4 1.4 19 多弯角蜂巢珊瑚Favites flexuosa (Dana, 1846) 0.2 0.4 0.8 − 20 五边角蜂巢珊瑚Favites pentagona (Esper, 1794) 0.2 3.2 1 2.2 21 板叶角蜂巢珊瑚Favites complanata (Ehrenberg, 1834) − 0.2 0.6 − 22 海孔角蜂巢珊瑚Favites halicora (Ehrenberg, 1834) 0.2 1.4 2.4 1.2 23 罗素角蜂巢珊瑚Favites russelli (Wells, 1954) − − 0.2 − 24 粗糙菊花珊瑚Goniastrea aspera (Verrill, 1905) − 0.2 1.2 − 25 简短圆菊珊瑚Montastrea annuligera (Milne Edwards & Haime, 1849) − − − 0.4 26 肉质扁脑珊瑚Platygyra carnosus (Veron, 2000) 0.6 5 3.6 0.6 27 中华扁脑珊瑚Platygyra sinensis (Milne Edwards & Haime, 1849) 0.4 − 0.2 − 28 精巧扁脑珊瑚Platygyra daedalea (Ellis and Solander, 1786) 0.2 0.4 − − 29 小扁脑珊瑚Platygyra pini (Chevalier, 1975) − − 0.2 − 30 多孔同星珊瑚Plesiastrea versipora (Lamarck, 1816) 0.2 2.8 0.8 5 31 卷曲黑星珊瑚Oulastrea crispate (Lamarck, 1816) 0.4 − − − 32 白斑小星珊瑚Leptastrea pruinosa (Crossland, 1952) − − 0.2 1 33 紫小星珊瑚Leptastrea purpurea (Dana, 1846) − − − 0.6 34 锯齿刺星珊瑚Cyphastrea serailia (Forskal, 1775) − 0.6 − 0.6 35 澄黄滨珊瑚Porites lutea (Milne Edwards and Harime, 1851) 1.2 1.8 2 21.6 36 团块滨珊瑚 Porites lobata (Dana, 1846) − − − 0.6 37 柱角孔珊瑚Goniopora columna (Dana, 1846) − − 0.2 − 38 斯氏角孔珊瑚Goniopora stutchburyi (Wells, 1955) 0.8 − − 0.2 39 二异角孔珊瑚Goniopora duofasciata (Thiel, 1932) − − 0.4 − 注: “+”表示2021年调查有发现相应种类珊瑚;根据文献图片,粤东海区大陆认定的精巧扁脑和香港认定的肉质扁脑可能是同一种珊瑚;“−”代表在调查过程中未发现该种。 A2 大亚湾湾内活珊瑚覆盖度历年调查数据
A2 Records of live coral cover in the Daya Bay
调查年份 活珊瑚覆盖度/% 参考文献 大辣甲 小辣甲 白沙洲 1984/1985 72.7 78.1 77.7 张元林和邹仁林[31] 1991 32 32 − 温伟英等[32] 2003 22.9 58.8† − 林昭进等[30] 2006 20.5 − − 陈天然等[33] 2007 20.9 15.7 6.2 陈天然等[6] 2008 20.3 15.2 5.8 陈天然等[6] 2015 46.6‡ − − 张涛锂和练健生[29] 2020 9 20.2¶ − 郭峰等[28] 2020 11 7 2 本研究 注:†小辣甲北部小范围高值;‡采样站位不详,据前后数据分析可能也是小范围高值,据本文调查该值在大辣甲刷洲东岛是存在的;¶小辣甲东北部单站位,数据略高于本文调查;“−”代表无数据。 -
[1] International Coral Reef Initiative (ICRI), Global Coral Reef Monitoring Network (GCRMN), Australia Institute of Marine Science, United Nations Environment Programme (UNEP). Status of coral reefs of the world 2020[R/OL]. [2021−10−05]. https://www.unep.org/resources/status-coral-reefs-world-20202021. [2] 余克服. 珊瑚礁科学概论[M]. 北京: 科学出版社, 2018.Yu Kefu. Introduction to the Science of Coral Reefs[M]. Beijing: Science Press, 2018. [3] 中国太平洋学会珊瑚礁分会, 北京市企业家环保基金会. 中国珊瑚礁状况报告[R/OL]. [2020−09−07]. http://foundation.see.org.cn/news/2020/1116/476.html.Coral Reef Branch, Pacific Society of China, Beijing Entrepreneurs’ Environment Protection Foundation. Status of coral reefs of China 2019[R/OL]. [2020−09−07]. http://foundation.see.org.cn/news/2020/1116/476.html. [4] 张乔民. 我国热带生物海岸的现状及生态系统的修复与重建[J]. 海洋与湖沼, 2001, 32(4): 454−464.Zhang Qiaomin. Status of tropical biological coasts of China: implications on ecosystem restoration and reconstruction[J]. Oceanologia et Limnologia Sinica, 2001, 32(4): 454−464. [5] Bellwood D R, Hughes T P, Folke C, et al. Confronting the coral reef crisis[J]. Nature, 2004, 429(6994): 827−833. doi: 10.1038/nature02691 [6] 陈天然, 余克服, 施祺, 等. 大亚湾石珊瑚群落近25年的变化及其对2008年极端低温事件的响应[J]. 科学通报, 2009, 54(6): 812−820.Chen Tianran, Yu Kefu, Shi Qi, et al. Twenty-five years of change in scleractinian coral communities of Daya Bay (northern South China Sea) and its response to the 2008 AD extreme cold climate event[J]. Chinese Science Bulletin, 2009, 54(12): 2107−2117. [7] 赵美霞, 余克服, 张乔民, 等. 近50年来三亚鹿回头岸礁活珊瑚覆盖率的动态变化[J]. 海洋与湖沼, 2010, 41(3): 440−447.Zhao Meixia, Yu Kefu, Zhang Qiaomin, et al. Long-term change in coral cover in Luhuitou fringing reef, Sanya[J]. Oceanologia et Limnologia Sinica, 2010, 41(3): 440−447. [8] Gardner T A, Côté I M, Gill J A, et al. Long-term region-wide declines in Caribbean corals[J]. Science, 2003, 301(5635): 958−960. doi: 10.1126/science.1086050 [9] Wong K T, Chui A P Y, Lam E K Y, et al. A 30-year monitoring of changes in coral community structure following anthropogenic disturbances in Tolo Harbour and Channel, Hong Kong[J]. Marine Pollution Bulletin, 2018, 133: 900−910. doi: 10.1016/j.marpolbul.2018.06.049 [10] Hastings R A, Rutterford L A, Freer J J, et al. Climate change drives poleward increases and equatorward declines in marine species[J]. Current Biology, 2020, 30(8): 1572−1577. e2. [11] 汪子芳. 对生长环境要求极高 南麂海域新发现三种造礁石珊瑚[N]. 浙江新闻, 2022−09−16.Wang Zifang. Three scleratinia coral species were found in Nanji, which were environmental demanding[N]. Zhejiang News, 2022−09−16. [12] Nomura K. Recent changes in coral communities in Kushimoto, the southernmost part of Honshu, Japan[J]. Journal of the Japanese Coral Reef Society, 2009, 11(1): 39−49. doi: 10.3755/jcrs.11.39 [13] 韩舞鹰, 马克美. 粤东沿岸上升流的研究[J]. 海洋学报, 1988, 10(1): 52−59.Han Wuying, Ma Kemei. The upwelling along the coast of east Guangdong[J]. Haiyang Xuebao, 1988, 10(1): 52−59. [14] 王友绍, 王肇鼎, 黄良民. 近20年来大亚湾生态环境的变化及其发展趋势[J]. 热带海洋学报, 2004, 23(5): 85−95.Wang Youshao, Wang Zhaoding, Huang Liangmin. Environment changes and trends in Daya Bay in recent 20 years[J]. Journal of Tropical Oceanography, 2004, 23(5): 85−95. [15] English S, Wilkinson C, Baker V. Survey Manual for Tropical Marine Resources[M]. Townsville: Australian Institute of Marine Science, 1994. [16] 徐恭昭. 大亚湾环境与资源[M]. 合肥: 安徽科学技术出版社, 1989.Xu Gongzhao. Environment and Resource in Daya Bay[M]. Hefei: Anhui Science and Technology Publishing House, 1989. [17] 李立, 张炳楷, 曾刚. 大亚湾的海流特征[C]//国家海洋局第三海洋研究所. 大亚湾海洋生态文集(II). 北京: 海洋出版社, 1990.Li li, Zhang Bingkai, Zeng Gang. Currents of daya bay[C]//Third Institute of Oceanography, State Oceanic Administration. Collections of Papers on Marine Ecology in the Daya Bay(II). Beijing: China Ocean Press, 1990. [18] 王伟强, 卢美鸾. 大亚湾贫氧现象的探讨[C]//国家海洋局第三海洋研究所. 大亚湾海洋生态文集(II). 北京: 海洋出版社, 1990.Wang Weiqiang, Lu Meiluan. Discussion on low oxygen seawater in Daya Bay[C]//Third Institute of Oceanography, State Oceanic Administration. Collections of Papers on Marine Ecology in the Daya Bay(II). Beijing: China Ocean Press, 1990. [19] 韩舞鹰, 马克美. 粤东沿岸上升流氧的各种变化过程[J]. 热带海洋, 1991, 10(3): 65−70.Han Wuying, Ma Kemei. Processes of oxygen change in the upwelling along the coast of East Guangdong[J]. Tropic Oceanology, 1991, 10(3): 65−70. [20] 曾刚, 许金殿, 张炳楷. 大亚湾海水温度的时空分布[J]. 台湾海峡, 1991, 10(2): 110−116.Zeng Gang, Xu Jindian, Zhang Bingkai. Temporal and spacial distribution of water temperature in Daya Bay[J]. Journal of Oceanography in Taiwan Strait, 1991, 10(2): 110−116. [21] 李立, 陈义斌. 大亚湾水温层化的季节性突变[J]. 海洋科学, 1992(6): 61−63.Li Li, Chen Yibin. Sudden change of Daya Bay temperature stratification in September[J]. Marine Sciences, 1992(6): 61−63. [22] 曾刚, 李立, 许金殿, 等. 大亚湾西部和北部浅水区夏半年的温、盐度分析[J]. 台湾海峡, 1992, 11(1): 28−34.Zeng Gang, Li Li, Xu Jindian, et al. Analysis of summer water temperature and salinity in shallow waters of western and northern Daya Bay[J]. Journal of Oceanography in Taiwan Strait, 1992, 11(1): 28−34. [23] Collinson P R J. The ecology of a peripheral, subtropical coral community in Hong Kong[D]. Hong Kong, China: The University of Hong Kong, 1997. [24] Chen Tianran, Yu Kefu, Chen Tegu. Sr/Ca–sea surface temperature calibration in the coral Porites lutea from subtropical northern South China Sea[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2013, 392: 98−104. doi: 10.1016/j.palaeo.2013.09.004 [25] 胡蓉, 魏艳, 马方方. 大鹏湾两次溶解氧骤降事件对比与分析[J]. 海洋技术学报, 2014, 33(2): 24−28.Hu Rong, Wei Yan, Ma Fangfang. Comparison and analysis of two dissolved oxygen reduction events in the Dapeng Bay[J]. Journal of Ocean Technology, 2014, 33(2): 24−28. [26] 杨熙. 大亚湾夏季浮游植物群落结构的长期变化及其影响因素[D]. 北京: 中国科学院大学, 2021.Yang Xi. Long-term changes in summer phytoplankton community and their influencing factors in Daya Bay[D]. Beijing: University of Chinese Academy of Science, 2021. [27] 香港特别行政区政府. 环境保护署[EB/OL]. [2023−04−01]. https://www.epd.gov.hk.The Government of the Hong Kong Special Administrative Region (China). Hong Kong environmental protection department[EB/OL]. [2023−04−01]. https://www.epd.gov.hk. [28] 郭峰, 肖家光, 田鹏, 等. 大亚湾及大鹏半岛沿岸造礁石珊瑚现状与生态脆弱性评价[J]. 应用海洋学学报, 2022, 41(4): 568−582.Guo Feng, Xiao Jiaguang, Tian Peng, et al. Status of scleractinian corals in Daya Bay and along the coast of Dapeng Peninsula and ecological vulnerability assessment[J]. Journal of Applied Oceanography, 2022, 41(4): 568−582. [29] 张涛锂, 练健生. 大亚湾造礁石珊瑚现状[J]. 海洋与渔业, 2018(7): 104−105.Zhang Taoli, Lian Jiansheng. The status of scleractinian corals in Daya Bay[J]. Ocean and Fishery, 2018(7): 104−105. [30] 林昭进, 邱永松, 张汉华, 等. 大亚湾浅水石珊瑚的分布现状及生态特点[J]. 热带海洋学报, 2007, 26(3): 63−67.Lin Zhaojin, Qiu Yongsong, Zhang Hanhua, et al. Distribution and ecological characters of neritic stone corals at Daya Bay[J]. Journal of Tropical Oceanography, 2007, 26(3): 63−67. [31] 张元林, 邹仁林. 大亚湾浅水石珊瑚群落结构的研究[J]. 热带海洋, 1987, 6(1): 12−18.Zhang Yuanlin, Zou Renlin. Community structure of shallow water stony corals in Daya Bay[J]. Tropic Oceanology, 1987, 6(1): 12−18. [32] 温伟英, 邹仁林, 杜完成, 等. 大亚湾核电站温排水对石珊瑚群落的影响Ⅰ. 核电站运转前的石珊瑚群落[M]//潘金培, 蔡国雄. 中国科学院大亚湾海洋生物综合实验站研究年报(第1期). 北京: 科学出版社, 1996.Wen Weiying, Zou Renlin, Du Wancheng, et al. Impacts of warm effluent from the Daya Bay nuclear power plant on stony coral community I. Stony community before the operation of the nuclear power plant[M]//Pan Jinpei, Cai Guoxiong. Annual Research Reports, Marine Biology Research Station at Daya Bay, Chinese Academy of Science. Beijing: Science Press, 1996. [33] 陈天然, 余克服, 施祺, 等. 广东大亚湾石珊瑚群落的分布及动态变化[J]. 热带地理, 2007, 27(6): 493−498.Chen Tianran, Yu Kefu, Shi Qi, et al. Distribution and status of scleractinian coral communities in the Daya Bay, Guangdong[J]. Tropical Geography, 2007, 27(6): 493−498. [34] Cybulski J D, Husa S M, Duprey N N, et al. Coral reef diversity losses in China’s Greater Bay Area were driven by regional stressors[J]. Science Advances, 2020, 6(40): eabb1046. doi: 10.1126/sciadv.abb1046 [35] Ortiz J C, Pears R J, Beeden R, et al. Important ecosystem function, low redundancy and high vulnerability: the trifecta argument for protecting the Great Barrier Reef's tabular Acropora[J]. Conservation Letters, 2021, 14(5): e12817. doi: 10.1111/conl.12817 [36] Yeung Y H, Xie J Y, Kwok C K, et al. Hong Kong’s subtropical scleractinian coral communities: baseline, environmental drivers and management implications[J]. Marine Pollution Bulletin, 2021, 167: 112289. doi: 10.1016/j.marpolbul.2021.112289 [37] Lam K, Shin P K S, Hodgson P. Severe bioerosion caused by an outbreak of corallivorous Drupella and Diadema at Hoi Ha Wan Marine Park, Hong Kong[J]. Coral Reefs, 2007, 26(4): 893. doi: 10.1007/s00338-007-0288-9 [38] Yeung Y H, Xie J Y, Lai V C S, et al. Can portunid crabs protect massive coral against the attack by long-spined sea urchins?[J]. Regional Studies in Marine Science, 2020, 38: 101374. doi: 10.1016/j.rsma.2020.101374 [39] Chen Tianran, Li Shu, Yu Kefu. Macrobioerosion in Porites corals in subtropical northern South China Sea: a limiting factor for high-latitude reef framework development[J]. Coral Reefs, 2013, 32(1): 101−108. doi: 10.1007/s00338-012-0946-4 [40] Oliver J K, Berkelmans R, Eakin C M. Coral bleaching in space and time[M]//van Oppen M J H, Lough J M. Coral Bleaching: Patterns, Processes, Causes and Consequences. 2nd ed. Cham: Springer, 2018. [41] Jokiel P L, Hunter C L, Taguchi S, et al. Ecological impact of a fresh-water “reef kill” in Kaneohe Bay, Oahu, Hawaii[J]. Coral Reefs, 1993, 12(3): 177−184. [42] McCorry D. Hong Kong’s scleractinian coral communities: status, threats and proposals for management[D]. Hong Kong, China: The University of Hong Kong, 2002. [43] Fabricius K E, De’ath G, Puotinen M L, et al. Disturbance gradients on inshore and offshore coral reefs caused by a severe tropical cyclone[J]. Limnology and Oceanography, 2008, 53(2): 690−704. doi: 10.4319/lo.2008.53.2.0690 [44] Altieri A H, Harrison S B, Seemann J, et al. Tropical dead zones and mass mortalities on coral reefs[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(14): 3660−3665. [45] Johnson M D, Scott J J, Leray M, et al. Rapid ecosystem-scale consequences of acute deoxygenation on a Caribbean coral reef[J]. Nature Communications, 2021, 12(1): 4522. doi: 10.1038/s41467-021-24777-3 [46] Moriarty T, Leggat W, Huggett M J, et al. Coral disease causes, consequences, and risk within coral restoration[J]. Trends in Microbiology, 2020, 28(10): 793−807. doi: 10.1016/j.tim.2020.06.002 [47] Combs I R, Studivan M S, Eckert R J, et al. Quantifying impacts of stony coral tissue loss disease on corals in Southeast Florida through surveys and 3D photogrammetry[J]. PLoS One, 2021, 16(6): e0252593. doi: 10.1371/journal.pone.0252593 [48] Baird A H, Pratchett M S, Hoey A S, et al. Acanthaster planci is a major cause of coral mortality in Indonesia[J]. Coral Reefs, 2013, 32(3): 803−812. doi: 10.1007/s00338-013-1025-1 [49] 吴钟解, 王道儒, 涂志刚, 等. 西沙生态监控区造礁石珊瑚退化原因分析[J]. 海洋学报, 2011, 33(4): 140−146.Wu Zhongjie, Wang Daoru, Tu Zhigang, et al. The analysis on the reason of hermatypic coral degradation in Xisha[J]. Acta Oceanologica Sinica, 2011, 33(4): 140−146. [50] 李元超, 陈石泉, 郑新庆, 等. 永兴岛及七连屿造礁石珊瑚近10年变化分析[J]. 海洋学报, 2018, 40(8): 97−109.Li Yuanchao, Chen Shiquan, Zheng Xinqing, et al. Analysis of the change of hermatypic corals in Yongxing Island and Qilianyu Island in nearly a decade[J]. Haiyang Xuebao, 2018, 40(8): 97−109. [51] Maragos J E. Engineering on coral reefs with emphasis on pacific reefs[M]//Hopley D. Encyclopedia of Modern Coral Reefs. Encyclopedia of Earth Sciences Series. Dordrecht: Springer, 2011. [52] Li Xiubao, Huang Hui, Lian Jiansheng, et al. Coral community changes in response to a high sedimentation event: a case study in southern Hainan Island[J]. Chinese Science Bulletin, 2013, 58(9): 1028−1037. doi: 10.1007/s11434-012-5601-5 [53] Scott P J B, Cope M. Tolo revisited: a survey of the corals in Tolo Harbour and Channel six years and half a million people later[M]//Morton B. The Marine Flora and Fauna of Hong Kong and Southern China II. Hong Kong, China: Hong Kong University Press, 1990. [54] Chen Tianran, Yu Kefu, Li Shu, et al. Heavy metal pollution recorded in Porites corals from Daya Bay, northern South China Sea[J]. Marine Environmental Research, 2010, 70(3−4): 318−326. doi: 10.1016/j.marenvres.2010.06.004 [55] Chen Tianran, Yu Kefu. P/Ca in coral skeleton as a geochemical proxy for seawater phosphorus variation in Daya Bay, northern South China Sea[J]. Marine Pollution Bulletin, 2011, 62(10): 2114−2121. doi: 10.1016/j.marpolbul.2011.07.014 [56] Williams Jr E H, Bunkley-Williams L. The world-wide coral reef bleaching cycle and related sources of coral mortality[J]. Atoll Research Bulletin, 1990, 335: 1−71. doi: 10.5479/si.00775630.335.1 [57] Glynn P W. Coral reef bleaching in the 1980s and possible connections with global warming[J]. Trends in Ecology & Evolution, 1991, 6(6): 175−179. [58] Wilkinson C R. Status of coral reefs of the world[R]. Townsville, Australia: Global Coral Reef Monitoring Network and Australian Institute of Marine Science, 2000. [59] Hughes T P, Kerry J T, Baird A H, et al. Global warming transforms coral reef assemblages[J]. Nature, 2018, 556(7702): 492−496. doi: 10.1038/s41586-018-0041-2 [60] The National Aeronautics and Space Administration (NASA). Giovanni[EB/OL]. [2022−11−14]. https://giovanni.gsfc.nasa.gov/giovanni/. [61] 惠州市海洋与渔业局大亚湾经济技术开发区分局. 政务公开[EB/OL]. [2022−09−22]. http://www.dayawan.gov.cn/hzdywhyyyj/gkmlpt/index.Daya Bay Economic and Technological Development Zone Substation of the Huizhou Marine and Fishery Bureau. Open government affairs[EB/OL]. [2022−09−22]. http://www.dayawan.gov.cn/hzdywhyyyj/gkmlpt/index. [62] Delbeek J C, Richards Z, Lovell E, et al. Acropora pruinosa [EB/OL]. [2008−01−01]. https://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T133128A3586482.en. [63] 卢晨. 广东南澎列岛发现造礁珊瑚群落[N]. 中国海洋报, 2019−11−12.Lu Chen. Hermatic coral communities was discovered in Nanpeng Islands, Guangdong[N]. China Ocean News, 2019−11−12. [64] Higuchi T, Agostini S, Casareto B E, et al. The northern limit of corals of the genus Acropora in temperate zones is determined by their resilience to cold bleaching[J]. Scientific Reports, 2015, 5(1): 18467. doi: 10.1038/srep18467 [65] Pipithkul S, Ishizu S, Shimura A, et al. High clonality and geographically separated cryptic lineages in the threatened temperate coral, Acropora pruinosa[J]. Frontiers in Marine Science, 2021, 8: 668043. doi: 10.3389/fmars.2021.668043 [66] Veron J E N, Hodgson G. Annotated checklist of the hermatypic corals of the Philippines[J]. Pacific Science, 1989, 43(3): 234−287. [67] De K, Venkataramanc K, Ingolea B. The hard corals (Scleractinia) of India: a revised checklist[J]. Indian Journal of Geo Marine Sciences, 2020, 49(10): 1651−1660. [68] Sadhukhan K, Raghunathan C. Diversity and abundance of scleractinia corals in Car Nicobar Island, India[J]. International Journal of Plant, Animal and Environmental Sciences, 2011, 1(3): 150−157. [69] Berkelmans R. Bleaching and mortality thresholds: how much is too much? [M]//van Oppen M J H, Lough J M. Coral Bleaching. Ecological Studies, 233. Cham: Springer, 2018. [70] Eakin C M, Lough J M, Heron S F, et al. Climate variability and change: monitoring data and evidence for increased coral bleaching stress[M]//van Oppen M J H, Lough J M. Coral Bleaching. Ecological Studies, 233. Cham: Springer, 2018. [71] Clark T R, Chen Xuefei, Leonard N D, et al. Episodic coral growth in China’s subtropical coral communities linked to broad-scale climatic change[J]. Geology, 2019, 47(1): 79−82. doi: 10.1130/G45278.1 [72] Romero-Torres M, Acosta A, Palacio-Castro A M, et al. Coral reef resilience to thermal stress in the Eastern Tropical Pacific[J]. Global Change Biology, 2020, 26(7): 3880−3890. doi: 10.1111/gcb.15126 [73] Xie J Y, Lau D C C, Kei K, et al. The 2014 summer coral bleaching event in subtropical Hong Kong[J]. Marine Pollution Bulletin, 2017, 124(2): 653−659. doi: 10.1016/j.marpolbul.2017.03.061 [74] Xie J Y, Yeung Y H, Kwok C K, et al. Localized bleaching and quick recovery in Hong Kong’s coral communities[J]. Marine Pollution Bulletin, 2020, 153: 110950. doi: 10.1016/j.marpolbul.2020.110950 [75] 香港天文台. 气候资料服务[EB/OL]. [2022−09−12]. https://www.hko.gov.hk/tc/cis/climat.htm.Climate Information Services. Hongkong Observatory[EB/OL]. [2022−09−21]. https://www.hko.gov.hk/tc/cis/climat.htm. [76] Morton B, Wu S S. The hydrology of the coastal waters of Hong Kong[J]. Environmental Research, 1975, 10(3): 319−347. doi: 10.1016/0013-9351(75)90029-8 [77] 黄礼琪. 大亚湾现大量死鱼 官方确认是由洋流引起[N]. 羊城晚报, 2013−07−12.Huang Liqi. Mass fish death in Daya Bay was caused by currents[N]. Yangcheng Evening News, 2013−07−12. [78] 温潇潇, 张蓓. 深圳海域休渔期发现成片死鱼, 渔政确认炸鱼所致将进一步调查[N]. 澎湃新闻, 2017−06−08.Wen Xiaoxiao, Zhang Bei. Mass fish death was caused by fish bombing in Shenzhen during fishing moratorium[N]. Penghu News, 2017−06−08. [79] 杨振. 深圳大亚湾海域大量鲻鱼死亡 海洋监测部门称系赤潮所致[N]. 央广新闻, 2017−08−17.Yang Zhen. Mass mullet death was caused by red tide[N]. CCTV News, 2017−08−17. [80] 丘耀文, 王肇鼎, 朱良生. 大亚湾海域营养盐与叶绿素含量的变化趋势及其对生态环境的影响[J]. 台湾海峡, 2005, 24(2): 131−139.Qiu Yaowen, Wang Zhaoding, Zhu Liangsheng. Variation trend of nutrient and chlorophyll contents and their effects on ecological environment in Daya Bay[J]. Journal of Oceanography in Taiwan Strait, 2005, 24(2): 131−139. [81] 何玉新, 黄小平, 黄良民, 等. 大亚湾养殖海域营养盐的周年变化及其来源分析[J]. 海洋环境科学, 2005, 24(4): 20−23.He Yuxin, Huang Xiaoping, Huang Liangmin, et al. Annual variation and analysis of nutrients in aquaculture area of Daya Bay[J]. Marine Environmental Science, 2005, 24(4): 20−23. [82] 姜犁明, 董良飞, 杨季芳, 等. 大亚湾海域N、P营养盐分布特征研究[J]. 常州大学学报(自然科学版), 2013, 25(2): 12−15.Jiang Liming, Dong Liangfei, Yang Jifang, et al. Distribution features of nutrients in Daya Bay[J]. Journal of Changzhou University (Natural Science Edition), 2013, 25(2): 12−15. [83] 杨文超, 黄道建, 陈继鑫, 等. 大亚湾海域2009−2015年氮、磷营养盐时空分布及富营养化评价[J]. 南方水产科学, 2020, 16(2): 54−61.Yang Wenchao, Huang Daojian, Chen Jixin, et al. Spatio-temporal distribution and eutrophication assessment of nutrients in Daya Bay during 2009–2015[J]. South China Fisheries Science, 2020, 16(2): 54−61. [84] 温伟英, 何悦强, 郑庆华, 等. 大亚湾的环境研究[J]. 热带海洋, 1992, 11(2): 25−30.Wen Weiying, He Yueqiang, Zheng Qinghua, et al. A study on the environment of Daya Bay[J]. Tropic Oceanology, 1992, 11(2): 25−30. [85] 彭云辉, 王肇鼎, 孙丽华, 等. 大亚湾微表层和次表层海水营养盐的研究[J]. 台湾海峡, 2002, 21(3): 310−316.Peng Yunhui, Wang Zhaoding, Sun Lihua, et al. Studies on nutrients of sea-surface microlayer and hipolayer at Daya Bay[J]. Journal of Oceanography in Taiwan Strait, 2002, 21(3): 310−316. [86] 李纯厚, 徐姗楠, 杜飞雁, 等. 大亚湾生态系统对人类活动的响应及健康评价[J]. 中国渔业质量与标准, 2015, 5(1): 1−10.Li Chunhou, Xu Shannan, Du Feiyan, et al. Responses of the Daya Bay ecosystem to human activities and health assessment[J]. Chinese Fishery Quality and Standards, 2015, 5(1): 1−10. [87] 王亮根, 李亚芳, 杜飞雁, 等. 大亚湾人工鱼礁区和岛礁区浮游动物群落特征及对仔稚鱼的影响[J]. 南方水产科学, 2018, 14(2): 41−50. doi: 10.3969/j.issn.2095-0780.2018.02.006Wang Lianggen, Li Yafang, Du Feiyan, et al. Zooplankton community characteristics and impact on ichthyoplankton in artificial reefs and island reefs of Daya Bay[J]. South China Fisheries Science, 2018, 14(2): 41−50. doi: 10.3969/j.issn.2095-0780.2018.02.006 [88] 宋星宇, 林雅君, 张良奎, 等. 粤港澳大湾区近海中小型浮游动物分布特征及影响因素[J]. 热带海洋学报, 2023, 42(3): 136−148. doi: 10.11978/2022137Song Xingyu, Lin Yajun, Zhang Liangkui, et al. Distribution characteristics and influencing factors of meso- and micro-zooplankton communities in the offshore waters of the Guangdong-Hong Kong-Macao Greater Bay Area[J]. Journal of Tropical Oceanography, 2023, 42(3): 136−148. doi: 10.11978/2022137 [89] Houlbrèque F, Ferrier-Pagès C. Heterotrophy in tropical scleractinian corals[J]. Biological Reviews, 2009, 84(1): 1−17. doi: 10.1111/j.1469-185X.2008.00058.x [90] Meunier V, Bonnet S, Pernice M, et al. Bleaching forces coral’s heterotrophy on diazotrophs and Synechococcus[J]. The ISME Journal, 2019, 13(11): 2882−2886. doi: 10.1038/s41396-019-0456-2 -




 下载:
下载: