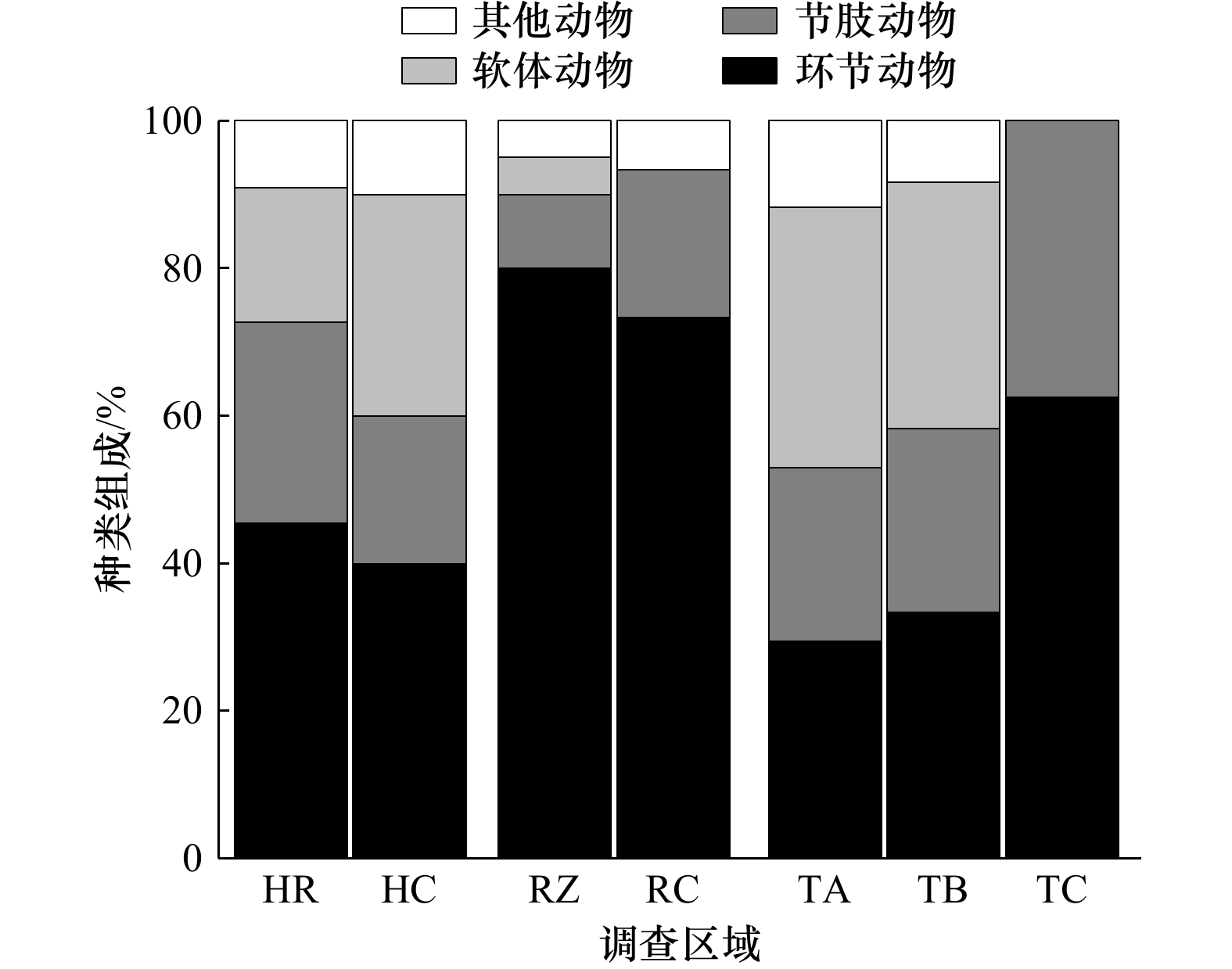
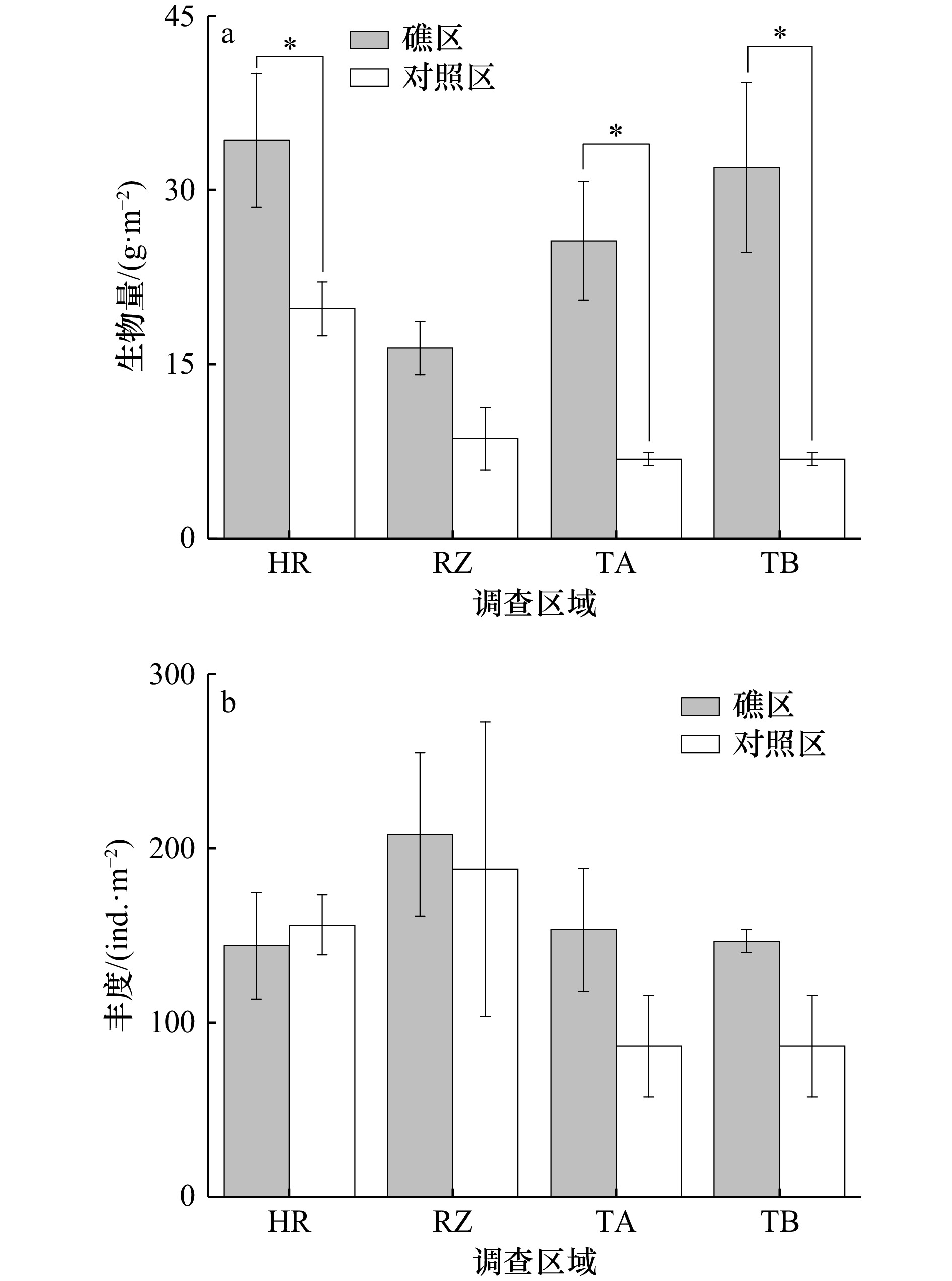
Effects of artificial reef construction on macrobenthos communities: A case study of four artificial reefs in the Yellow Sea and Bohai Sea
-
摘要: 为探究黄、渤海不同人工鱼礁区大型底栖动物群落的结构特征差异及评估人工鱼礁对生物资源的养护效果,于2021年秋季对黄、渤海海域4处人工鱼礁区的大型底栖动物开展了同期调查。共采集大型底栖动物61种,其中环节动物种类占比最多(47.54%)。各礁区大型底栖动物生物量均高于各自对照区,其中长礁龄礁区大型底栖动物资源养护效果最好,其平均生物量为对照区的4.19倍;各礁区的多样性指数H'和丰富度指数d也高于各自对照区,并表现出长礁龄礁区高于短礁龄礁区;ABC曲线表明,长礁龄礁区的生物群落稳定性优于短礁龄的礁区。各人工鱼礁区的优势种存在不同,多毛类为各礁区普遍存在的优势种;聚类分析及非度量多维尺度排序(NMDS)均大致将礁区调查站位分为3组,相似性分析检验(ANOSIM)表明各礁区之间的群落结构存在显著差异(R = 0.651,p < 0.01),相似性百分比分析(SIMPER)结果表明各礁区间的平均相异性百分比均在77%以上。研究结果表明人工鱼礁生境对大型底栖动物起到一定程度的养护作用,不同礁区间大型底栖动物群落存在差异,本研究可为人工鱼礁建设评价提供基础数据及依据。Abstract: In order to explore the differences in the structural characteristics of macrobenthos communities in different artificial reefs in the Yellow Sea and Bohai Sea and to evaluate the conservation effect of artificial reefs on biological resources, a simultaneous survey of macrobenthos in four artificial reefs in the Yellow Sea and Bohai Sea was carried out in autumn 2021. A total of 61 macrobenthos species were collected, among which annelids accounted for the most (47.54%). The biomass of macrobenthos in each reef area was higher than that in the control area, and the conservation effect of macrobenthos resources in the old reef area was the best, and the average biomass was 4.19 times that of the control area. The Shannon-Wiener index H' and richness index d of each reef region were higher than those of the control region, and the long reef age region was higher than the short reef age region. The ABC curve shows that the stability of the community in the long-aged reefs is better than that in the short-aged reefs. There are different dominant species in each artificial reef area, but polychaetes are the dominant species in all artificial reef areas. Reef survey sites were roughly divided into 3 groups by cluster analysis and non-metric multidimensional scale ranking (NMDS). Similarity analysis test (ANOSIM) showed that there were significant differences in community structure among reefs (R = 0.651, p < 0.01). The results of SIMPER (percentage of similarity analysis) show that the average percentage of dissimilarity in each reef interval is above 77%. The results show that the artificial reef habitat plays a certain role in the conservation of macrobenthos, and the macrobenthos community varies in different reef regions. This study can provide basic data and basis for the evaluation of artificial reef construction.
-
Key words:
- macrobenthos /
- artificial reefs /
- community structure /
- Yellow Sea and Bohai Sea
-
表 1 各礁区基本概况
Tab. 1 Basic overview of each reef area
调查
地点礁体类型 礁体
规模/m3建成
年份底质
类型HR 混凝土礁(3 m × 3 m × 4 m) 3.97×104 2020年 粗黏土 RZ 混凝土礁(3 m × 3 m × 3 m) 1.53×104 2019年 粗黏土 TA 混凝土礁(1.8 m × 1.8 m × 1.7 m) 3.63×104 2018年 粗粉砂 TB 混凝土礁(1.8 m × 1.8 m × 1.7 m)
混凝土礁(1.8 m × 1.8 m × 4 m)4.76×104 2017年 细砂 表 2 各调查区域优势种分布
Tab. 2 Distribution of dominant species in each region
物种 优势度(Y) HR HC RZ RC TA TB TC 江户布目蛤Protothaca jedoensis 0.13 红带织纹螺Nassarius succinctus 0.09 丛生树蛰虫Pista fasciata 0.05 丝异须虫Heteromastus filiforms 0.21 0.06 0.05 蜾蠃蜚Corophium spp. 0.12 0.03 0.21 日本倍棘蛇尾
Amphioplus japonicus0.07 0.12 0.03 长吻沙蚕Glycera chirori 0.06 0.03 小巧毛刺蟹Pilumnus minutus 0.05 斜方五角蟹Nursia rhomboidalis 0.02 扁蛰虫Loimia medusa 0.02 不倒翁虫Sternaspis scutala 0.02 双唇索沙蚕
Lumbrineris cruzensis0.02 0.02 昆士兰稚齿虫
Prionospio queenslandica0.46 0.26 背蚓虫Notomastus latericeus 0.06 0.09 锥唇吻沙蚕Glycera onomichiensis 0.02 背褶沙蚕Tambalagamia fauveli 0.02 小亮樱蛤Nitidotellina minuta 0.09 长叶索沙蚕
Lumbrineris longiforlia0.09 丽小笔螺Mitrella bella 0.04 博氏双眼钩虾Ampelisca bocki 0.06 0.03 0.03 东方缝栖蛤Hiatella orientalis 0.05 0.03 裸盲蟹Typhlocarcinus nudus 0.08 纽虫Nemertea sp. 0.02 仙居虫Naineris laevigata 0.02 表 3 大型底栖动物不同区域的生物多样性指数
Tab. 3 Biodiversity indices of macrobenthos in different regions
区域 生物多样性指数 d H' J' HR 0.64 ± 0.22 1.27 ± 0.26 0.91 ± 0.05 HC 0.55 ± 0.16 1.20 ± 0.21 0.91 ± 0.06 RZ 0.88 ± 0.28 1.47 ± 0.45 0.86 ± 0.18 RC 0.71 ± 0.15 1.36 ± 0.19 0.92 ± 0.12 TA 0.79 ± 0.13* 1.51 ± 0.17 0.95 ± 0.01 TC 0.44 ± 0.16 1.00 ± 0.29 0.95 ± 0.04 TB 1.06 ± 0.09* 1.80 ± 0.09* 0.98 ± 0.03 TC 0.44 ± 0.16 1.00 ± 0.29 0.95 ± 0.04 注:*表示各礁区与其对照区间差异显著(p < 0.05)。 Note: * indicates significant difference between reef area and control interval (p < 0.05). 表 4 各礁区间主要分歧种及其相异性贡献率
Tab. 4 Main disproportionate species and dissimilarity contribution rates among different reef area
物种 组间相异性贡献率/% HR与RZ HR与TB RZ与TB HR与TA RZ与TA TB与TA 背蚓虫Notomastus latericeus 5.02 4.54 4.69 背褶沙蚕Tambalagamia fauveli 4.18 蜾蠃蜚Corophium sp. 8.01 6.82 8.93 红带织纹螺Nassarius succinctus 7.31 6.17 7.12 江户布目蛤Protothaca jedoensis 8.24 8.81 9.17 昆士兰稚齿虫Prionospio queenslandica 16.86 15.2 15.74 日本倍棘蛇尾Amphioplus japonicus 5.17 6.46 双唇索沙蚕Lumbrineris cruzensis 7.96 6.28 8.17 丝异须虫Heteromastus filiforms 5.71 4.81 6.47 小亮樱蛤Nitidotellina minuta 8.08 6.72 7.63 长吻沙蚕Glycera chirori 5.3 5.67 5.9 表 5 本研究与以往调查研究结果对比
Tab. 5 Comparison of research results
调查区域 调查时间 取样工具 种类数 平均丰度/(ind.·m−2) 平均生物量/(g·m−2) 日照近岸海域[36] 2007.10 0.05 m2抓斗式采泥器 142 1096.86 25.76 日照近岸海域[37] 2016.11 0.05 m2抓斗式采泥器 37 112.63 14.75 本研究RZ海域 2021.11 0.05 m2抓斗式采泥器 23 198 12.41 青岛近岸海域[38] 2007.10 0.25 m2抓斗式采泥器 160 431.73 22.30 青岛近岸海域[39] 2018.10 0.05 m2抓斗式采泥器 32 474 65.42 本研究HR海域 2021.11 0.05 m2抓斗式采泥器 15 150 27.05 渤海中部海域[40] 2006.11 0.1 m2箱式采泥器 214 1217 31.20 渤海海域[41] 2008.8 0.1 m2箱式采泥器 300 1094.7 11.78 本研究TA、TB海域 2021.10—11 0.05 m2抓斗式采泥器 22 129 21.47 -
[1] Chen Chen-Tung Arthur, Guo Xinyu. Changing Asia-Pacific Marginal Seas [M]. Singapore: Springer, 2020. [2] Chen Renli, Wu Xiaoqing, Liu Baijing, et al. Mapping coastal fishing grounds and assessing the effectiveness of fishery regulation measures with AIS data: A case study of the sea area around the Bohai Strait, China[J]. Ocean & Coastal Management, 2022, 223: 106136. [3] Zhang Ziyue, Yang Wei, Ding Jiewei, et al. Identifying changes in China’s Bohai and Yellow Sea fisheries resources using a causality-based indicator framework, convergent cross-mapping, and structural equation modeling[J]. Environmental and Sustainability Indicators, 2022, 14: 100171. doi: 10.1016/j.indic.2022.100171 [4] 杨红生, 丁德文. 海洋牧场3.0: 历程、现状与展望[J]. 中国科学院院刊, 2022, 37(6): 832−839.Yang Hongsheng, Ding Dewen. Marine ranching version 3.0: history, status and prospects[J]. Bulletin of Chinese Academy of Sciences, 2022, 37(6): 832−839. [5] 茹小尚, 邓贝妮, 冯其明, 等. 中外海洋牧场建设之比较[J]. 水产学报, 2023, 47(11): 119508.Ru Xiaoshang, Deng Beini, Feng Qiming, et al. Comparison of marine ranching constructions between China and foreign countries[J]. Journal of Fisheries of China, 2023, 47(11): 119508. [6] 杨红生, 章守宇, 张秀梅. 中国现代化海洋牧场建设的战略思考[J]. 水产学报, 2019, 43(4): 1255−1262.Yang Hongsheng, Zhang Shouyu, Zhang Xiumei, et al. Strategic thinking on the construction of modern marine ranching in China[J]. Journal of Fisheries of China, 2019, 43(4): 1255−1262. [7] 姜昭阳, 郭战胜, 朱立新, 等. 人工鱼礁结构设计原理与研究进展[J]. 水产学报, 2019, 43(9): 1881−1889.Jiang Zhaoyang, Guo Zhansheng, Zhu Lixin, et al. Structural design principle and research progress of artificial reef[J]. Journal of Fisheries of China, 2019, 43(9): 1881−1889. [8] An Tianchen, Lyu Junchen, Jia Wanxian, et al. Role of macrobenthic fauna in mangrove carbon fluxes indicated by their cellulase and hemicellulase activities[J]. Marine Biology Research, 2014, 10(9): 934−940. doi: 10.1080/17451000.2013.863355 [9] Griffiths J R, Kadin M, Nascimento F J A, et al. The importance of benthic-pelagic coupling for marine ecosystem functioning in a changing world[J]. Global Change Biology, 2017, 23(6): 2179−2196. doi: 10.1111/gcb.13642 [10] 李新正. 我国海洋大型底栖生物多样性研究及展望: 以黄海为例[J]. 生物多样性, 2011, 19(6): 676−684.Li Xinzheng. An overview of studies on marine macrobenthic biodiversity from Chinese waters: principally from the Yellow Sea[J]. Biodiversity Science, 2011, 19(6): 676−684. [11] Yan Jia, Xu Yong, Sui Jixing, et al. Long-term variation of the macrobenthic community and its relationship with environmental factors in the Yangtze River estuary and its adjacent area[J]. Marine Pollution Bulletin, 2017, 123(1−2): 339−348. doi: 10.1016/j.marpolbul.2017.09.023 [12] 张智鹏, 陈璐, 刘洪军, 等. 人工鱼礁建设对海洋浮游植物群落变化的影响[J]. 海洋通报, 2020, 39(5): 617−626.Zhang Zhipeng, Chen Lu, Liu Hongjun, et al. Effect of artificial reefs construction on phytoplankton community[J]. Marine Science Bulletin, 2020, 39(5): 617−626. [13] 陈传曦, 张建柏, 王新萌, 等. 渤海莱州湾芙蓉岛人工鱼礁区浮游动物群落结构特征及其与环境因子的关系[J]. 中国水产科学, 2021, 28(3): 299−313.Chen Chuanxi, Zhang Jianbo, Wang Xinmeng, et al. Zooplankton community structure and its relationship with environmental factors in an artificial reef near Furong Island, Laizhou Bay, Bohai Sea[J]. Journal of Fishery Sciences of China, 2021, 28(3): 299−313. [14] 刘鸿雁, 杨超杰, 张沛东, 等. 青岛崂山湾人工鱼礁区底层游泳动物群落结构特征[J]. 生物多样性, 2016, 24(8): 896−906. doi: 10.17520/biods.2016111Liu Hongyan, Yang Chaojie, Zhang Peidong, et al. Demersal nekton community structure of artificial reef zones in Laoshan Bay, Qingdao[J]. Biodiversity Science, 2016, 24(8): 896−906. doi: 10.17520/biods.2016111 [15] Song Minpeng, Wang Jiahao, Nie Zhaoyi, et al. Evaluation of artificial reef habitats as reconstruction or enhancement tools of benthic fish communities in northern Yellow sea[J]. Marine Pollution Bulletin, 2022, 182: 113968. doi: 10.1016/j.marpolbul.2022.113968 [16] 詹启鹏, 孙昕, 董建宇, 等. 莱州芙蓉岛海域人工鱼礁附着生物的群落结构和功能性状[J]. 中国水产科学, 2022, 29(5): 704−719.Zhan Qipeng, Sun Xin, Dong Jianyu, et al. Community structure and functional traits of attached organisms on an artificial reef near Furong Island, Laizhou Bay[J]. Journal of Fishery Sciences of China, 2022, 29(5): 704−719. [17] 王震, 公丕海, 关长涛, 等. 青岛石雀滩海域人工鱼礁材料对附着生物群落结构的影响[J]. 渔业科学进展, 2019, 40(4): 163−171.Wang Zhen, Gong Pihai, Guan Changtao, et al. Effect of different artificial reefs on the community structure of organisms in Shique Beach of Qingdao[J]. Progress in Fishery Sciences, 2019, 40(4): 163−171. [18] 任彬彬, 袁伟, 孙坚强, 等. 莱州湾金城海域鱼礁投放后大型底栖动物群落变化[J]. 应用生态学报, 2015, 26(6): 1863−1870.Ren Binbin, Yuan Wei, Sun Jianqiang, et al. Impact of artificial reef on community of macrobenthos in Jincheng area of Laizhou Bay, China[J]. Chinese Journal of Applied Ecology, 2015, 26(6): 1863−1870. [19] 张镇, 董建宇, 孙昕, 等. 莱州湾芙蓉岛人工鱼礁区大型底栖动物的营养结构特征[J]. 水产学报, 2023, 47(9): 099305.Zhang Zhen, Dong Jianyu, Sun Xin, et al. Trophic structure of macrobenthos in artificial reef area of Furong Island, Laizhou Bay[J]. Journal of Fisheries of China, 2023, 47(9): 099305. [20] 詹启鹏, 董建宇, 孙昕, 等. 芙蓉岛海域人工鱼礁投放对大型底栖动物群落结构和功能性状的影响[J]. 应用生态学报, 2023, 34(3): 796−804.Zhan Qipeng, Dong Jianyu, Sun Xin, et al. Impacts of artificial reef on community structure and functional traits of macrobenthos near Furong Island, Shandong, China[J]. Chinese Journal of Applied Ecology, 2023, 34(3): 796−804. [21] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 12763.6—2007, 海洋调查规范 第6部分: 海洋生物调查[S]. 北京: 中国标准出版社, 2008.General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China, Standardization Administration of the People’s Republic of China. GB/T 12763.6−2007, Specifications for oceanographic survey-Part 6: marine biological survey[S]. Beijing: China Standard Press, 2008. [22] Wilhm J L. Use of biomass units in Shannon's formula[J]. Ecology, 1968, 49(1): 153−156. doi: 10.2307/1933573 [23] Pielou E C. Species-diversity and pattern-diversity in the study of ecological succession[J]. Journal of Theoretical Biology, 1966, 10(2): 370−83. doi: 10.1016/0022-5193(66)90133-0 [24] Ulanowicz R E. Information theory in ecology[J]. Computers& Chemistry, 2001, 25(4): 393−399. [25] 刘旭东, 汪进生, 孙立娥, 等. 渤海山东近岸海域大型底栖动物的群落结构及多样性分析[J]. 海洋环境科学, 2021, 40(6): 929−936.Liu Xudong, Wang Jinsheng, Sun Li’e, et al. Community structure and diversity of macrozoobenthos at Bohai Sea off Shandong[J]. Marine Environmental Science, 2021, 40(6): 929−936. [26] Xu Yong, Sui Jixing, Yang Mei, et al. Variation in the macrofaunal community over large temporal and spatial scales in the southern Yellow Sea[J]. Journal of Marine Systems, 2017, 173: 9−20. doi: 10.1016/j.jmarsys.2016.11.006 [27] Hu Guikun, Zhang Qingtian. Seasonal variations in macrobenthic taxonomic diversity and the application of taxonomic distinctness indices in Bohai Bay, northern China[J]. Ecological Indicators, 2016, 71: 181−190. doi: 10.1016/j.ecolind.2016.07.001 [28] Jiang Shaoyu, Fan Wenzheng, Chen Linlin, et al. Spatio-temporal distribution of macrobenthos and benthic ecological health status in the Bohai Sea and the northern Yellow Sea, China[J]. Marine Pollution Bulletin, 2023, 196: 115671. doi: 10.1016/j.marpolbul.2023.115671 [29] 赵晨英, 臧家业, 刘军, 等. 黄渤海氮磷营养盐的分布、收支与生态环境效应[J]. 中国环境科学, 2016, 36(7): 2115−2127.Zhao Chenying, Zang Jiaye, Liu Jun, et al. Distribution and budget of nitrogen and phosphorus and their influence on the ecosystem in the Bohai Sea and Yellow Sea[J]. China Environmental Science, 2016, 36(7): 2115−2127. [30] 李亚芳, 杜飞雁, 王亮根, 等. 粤西海陵湾养殖区邻近海域大型底栖动物生态学特征[J]. 海洋与湖沼, 2018, 49(6): 1294−1307.Li Yafang, Du Feiyan, Wang Lianggen, et al. Ecology of macrobenthic fauna community in aquaculture zones of Hailing bay and adjacent waters along the western Guangdong coast, China[J]. Oceanologia et Limnologia Sinica, 2018, 49(6): 1294−1307. [31] Otani S, Kozuki Y, Kurata K, et al. Relationship between macrobenthos and physical habitat characters in tidal flat in eastern Seto Inland Sea, Japan[J]. Marine Pollution Bulletin, 2008, 57(1-5): 142−148. doi: 10.1016/j.marpolbul.2007.10.010 [32] 李东, 侯西勇, 唐诚, 等. 人工鱼礁研究现状及未来展望[J]. 海洋科学, 2019, 43(4): 81−87.Li Dong, Hou Xiyong, Tang Cheng, et al. A review on the progress of artificial reef research[J]. Marine Sciences, 2019, 43(4): 81−87. [33] 徐勤增, 许强, 张立斌, 等. 牡蛎壳人工礁对多毛纲底栖动物群落结构的影响[J]. 海洋与湖沼, 2013, 44(4): 1056−1061.Xu Qinzeng, Xu Qiang, Zhang Libin, et al. Effect of artificial oyster shell reef on benthic polychaeta community structure in Rongcheng Bay, China[J]. Oceanologia et Limnologia Sinica, 2013, 44(4): 1056−1061. [34] Zhou Hong, Zhang Zhinan, Liu Xiaoshou, et al. Changes in the shelf macrobenthic community over large temporal and spatial scales in the Bohai Sea, China[J]. Journal of Marine Systems, 2007, 67(3-4): 312−321. doi: 10.1016/j.jmarsys.2006.04.018 [35] Xu Yong, Ma Lin, Sui Jixing, et al. Potential effects of climate change on the habitat suitability of macrobenthos in the Yellow Sea and East China Sea[J]. Marine Pollution Bulletin, 2022, 174: 113238. doi: 10.1016/j.marpolbul.2021.113238 [36] 齐磊磊, 王其翔, 官曙光, 等. 日照近海大型底栖动物群落结构[J]. 渔业科学进展, 2013, 34(1): 97−102.Qi Leilei, Wang Qixiang, Guan Shuguang, et al. Community structure of macrobenthos in coastal waters of Rizhao[J]. Progress in Fishery Sciences, 2013, 34(1): 97−102. [37] 王尽文, 王燕, 黄娟, 等. 日照潮下带海域大型底栖动物春、秋季群落结构特征及其与环境因子的关系[J]. 应用海洋学学报, 2021, 40(4): 564−574.Wang Jinwen, Wang Yan, Huang Juan, et al. Community structures of macrobenthos and their relationship with environmental factors in Rizhao subtidal zone in spring and autumn[J]. Journal of Applied Oceanography, 2021, 40(4): 564−574. [38] 王宗兴, 范士亮, 徐勤增, 等. 青岛近海秋季大型底栖动物群落特征[J]. 海洋湖沼通报, 2010(1): 59−64.Wang Zongxing, Fan Shiliang, Xu Qinzeng, et al. Characters of macrobenthic community in autumn in the coastal water of Qingdao[J]. Transactions of Oceanology and Limnology, 2010(1): 59−64. [39] 纪莹璐, 张乃星, 王岚, 等. 小麦岛邻近海域秋季大型底栖动物生态特征[J]. 水产科学, 2022, 41(3): 388−397.Ji Yinglu, Zhang Naixing, Wang Lan, et al. Ecological characteristics of macrobenthos near Mai Island during autumn[J]. Fisheries Science, 2022, 41(3): 388−397. [40] 周红, 华尔, 张志南. 秋季莱州湾及邻近海域大型底栖动物群落结构的研究[J]. 中国海洋大学学报, 2010, 40(8): 80−87.Zhou Hong, Hua Er, Zhang Zhinan. Community structure of macrobenthos in Laizhou Bay and adjacent waters[J]. Periodical of Ocean University of China, 2010, 40(8): 80−87. [41] 刘晓收, 范颖, 史书杰, 等. 渤海大型底栖动物种类组成与群落结构研究[J]. 海洋学报, 2014, 36(12): 53−66.Liu Xiaoshou, Fan Ying, Shi Shujie, et al. Studies on the species composition and community structure of macrofauna in the Bohai Sea, China[J]. Acta Oceanologica Sinica, 2014, 36(12): 53−66. [42] Fabi G, Luccarini F, Panfili M, et al. Effects of an artificial reef on the surrounding soft-bottom community (central Adriatic Sea)[J]. ICES Journal of Marine Science, 2002, 59: 343−349. doi: 10.1006/jmsc.2002.1308 [43] 陈晨, 焦海峰, 王一农, 等. 象山港海洋牧场示范区大型底栖生物的时空变化[J]. 海洋与湖沼, 2016, 47(1): 130−139.Chen Chen, Jiao Haifeng, Wang Yinong, et al. Temporal and spatial changes of macrobenthos in marine pasture demonstration area in Xiangshan Bay[J]. Oceanologia et Limnologia Sinica, 2016, 47(1): 130−139. [44] Liu Guoshan, Li Wentao, Zhang Xiumei. Assessment of the benthic macrofauna in an artificial shell reef zone in Shuangdao Bay, Yellow Sea[J]. Marine Pollution Bulletin, 2017, 114(2): 778−785. doi: 10.1016/j.marpolbul.2016.11.004 [45] 崔恩苹, 张永强, 祝琳, 等. 千里岩岛西部人工鱼礁建设对周边海域水动力影响的数值模拟[J]. 海洋地质前沿, 2021, 37(2): 10−20.Cui Enping, Zhang Yongqiang, Zhu Lin, et al. Numerical simulation of the influence of artificial reefs on marine hydrodynamics to the west of Qianliyan Island[J]. Marine Geology Frontiers, 2021, 37(2): 10−20. [46] Sinmpson T J S, Smale D A, MeDonald J I, et al. Large scale variability in the structure of sessile invertebrate assemblages in artificial habitats reveals the importance of local-scale processes. Jourmal of Experimental Marine Biology and Ecology, 2017, 494: 10-19. [47] Antoniadou C, Voultsiadou E, Chintiroglou C. Benthic colonization and succession on temperate sublittoral rocky cliffs. Journal of Experimental Marine Biology and Ecology, 2010, 382(2): 145-153. [48] Yang Xinyuan, Lin Chenggang, Song Xiaoyue, et al. Effects of artificial reefs on the meiofaunal community and benthic environment - A case study in Bohai Sea, China[J]. Marine Pollution Bulletin, 2019, 140: 179−187. doi: 10.1016/j.marpolbul.2018.12.031 [49] Guilbeau B P, Harry F P, Gambrell R P, et al. Algae attachment on carbonated cements in fresh and brackish waters-preliminary results[J]. Ecological Engineering, 2003, 20(4): 309−319. doi: 10.1016/S0925-8574(03)00026-0 [50] Putro S P, Widowati W, Suhartana U. Assessment level of severity of environmental disturbance caused by aquaculture activities using abundance-biomass curves of macrobenthic assemblages[J]. International Journal of Environmental Science and Development, 2015, 6(3): 178−181. doi: 10.7763/IJESD.2015.V6.585 [51] 孙习武, 张硕, 赵裕青, 等. 海州湾人工鱼礁海域鱼类和大型无脊椎动物群落组成及结构特征[J]. 上海海洋大学学报, 2010, 19(4): 505−513.Sun Xiwu, Zhang Shuo, Zhao Yuqing, et al. Community structure of fish and macroinvertebrates in the artificial reef sea area of Haizhou Bay[J]. Journal of Shanghai Ocean University, 2010, 19(4): 505−513. [52] Chowdhury M S N, Hossain M S, Ysebaert T, et al. Do oyster breakwater reefs facilitate benthic and fish fauna in a dynamic subtropical environment?[J]. Ecological Engineering, 2020, 142: 105635. doi: 10.1016/j.ecoleng.2019.105635 -




 下载:
下载: