Hourly variations of partial pressure of CO2 in surface sea water and its controlling mechanisms in the northeastern Beibu Gulf in spring and summer
-
摘要: 周日观测对掌握近海碳酸盐体系变化和海−气CO2交换过程是必要的,有助于降低碳源汇评估的不确定性。针对北部湾东北部的英罗湾−安铺港海域,于2018年4月和8月利用24 h定点逐时采样观测了该区域表层海水碳酸盐体系及相关要素,分析了春、夏季的表层海水CO2分压(pCO2)24 h逐时变化规律及其调控因子。观测结果表明,春、夏季pCO2变化范围分别为530~628 μatm和427~748 μatm,平均海−气CO2通量分别为(1.7±0.8)mmol/(m2·d)和(1.2±0.8)mmol/(m2·d),均表现为大气CO2的弱源。其中春季pCO2 24 h逐时变化受温度的影响相比夏季更显著,而夏季pCO2对潮汐作用以及区域内沿岸河流、地下水等淡水汇入引起的生物生产和呼吸代谢过程增强的响应更明显。海水升温主导了春季区域表层高pCO2的形成,夏季咸淡水的物理混合过程中增强的生物生产对表层溶解无机碳(DIC)起到降低作用,区域内的红树林、盐沼等生态系统对淡水端的DIC添加有一定的贡献。水团DIC浓度与总碱度(TA)的比值变化可反映英罗湾−安铺港海域pCO2湾内高、湾外低的总体分布格局。Abstract: Diurnal observation is necessary for grasping the variability of carbonate system in coastal waters and sea-air CO2 exchange process and is helpful to reduce the uncertainty of assessments for carbon source/sink. Surface carbonate system and related parameters were obtained during twice 24 hours fixed sampling and observation conducted in April and August 2018 in the Yingluo Bay-Anpu Harbor, located in the northeastern Beibu Gulf. In this paper, we analyzed the hourly variations of partial pressure of CO2 in surface sea water (pCO2) and discussed the corresponding environment factors controlling pCO2 in both seasons. The pCO2 values ranged from 530−628 μatm in spring to 427−748 μatm in summer, with the average sea-air CO2 flux in spring and summer for (1.7±0.8) mmol/(m2·d) and (1.2±0.8) mmol/(m2·d), respectively. The study area acted as a weak CO2 source during both seasons. The hourly changes of pCO2 in spring were more significantly affected by temperature effects than in summer. During summertime, pCO2 had more sensibly response to tidal action, enhanced biological production and respiration with inflow of coastal freshwater such as rivers and submarine groundwater discharge. Water warming dominated the formation of high pCO2 in spring. The enhanced biological production during the physical mixing of saline and fresh water played a role in the drawdown of surface dissolved inorganic carbon (DIC) and the mangroves and salt marshes ecosystems along the bay had a certain contribution to the addition of DIC on the freshwater end-member in summer. The variations of the ratio of DIC concentration and total alkalinity (TA) in the water masses could imply the overall distribution pattern adjacent to the Yingluo Bay-Anpu Harbor that high values exists in the bay and lower values exists in offshore water.
-
Key words:
- Beibu Gulf /
- Yingluo Bay-Anpu Harbor /
- partial pressure of CO2 /
- sea-air CO2 flux
-
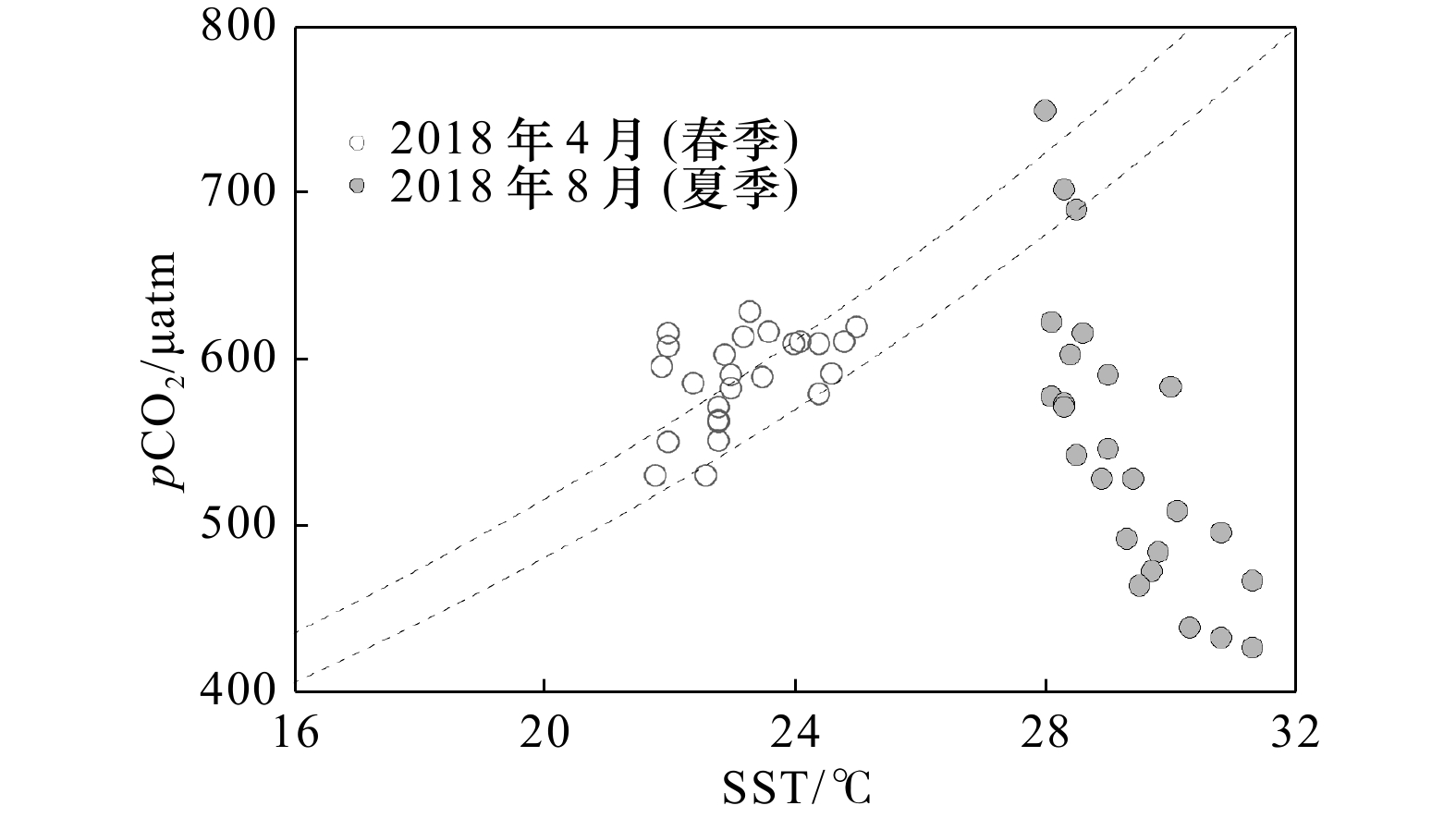
图 3 观测期间C1站pCO2与SST的关系
两条灰色虚线表征pCO2的温度控制曲线,分别为pCO2=560 μatm×exp[0.042 3×(SST−23.2℃)](下部线)和pCO2=600 μatm×exp[0.042 3×(SST−23.2℃)](上部线)
Fig. 3 Relationship between pCO2 and SST at Station C1 during the observations
The two grey dashed lines represent the SST-pCO2 functions of pCO2=560 μatm×exp[0.042 3×(SST−23.2℃)] (lower line) and of pCO2=600 μatm×exp[0.042 3×(SST−23.2℃)] (upper line), respectively
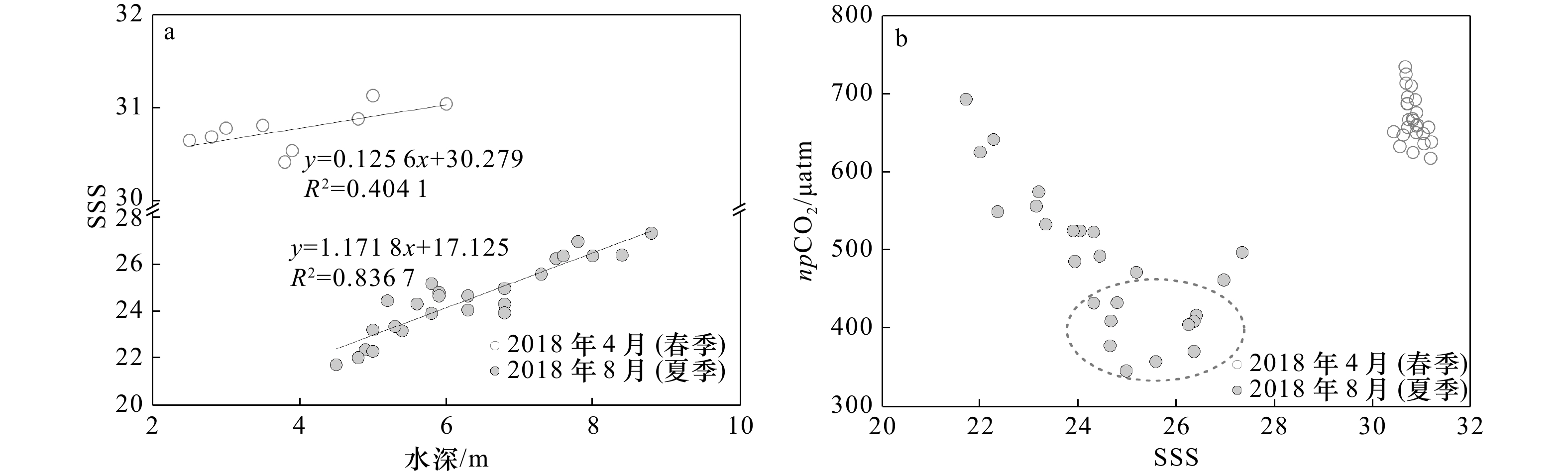
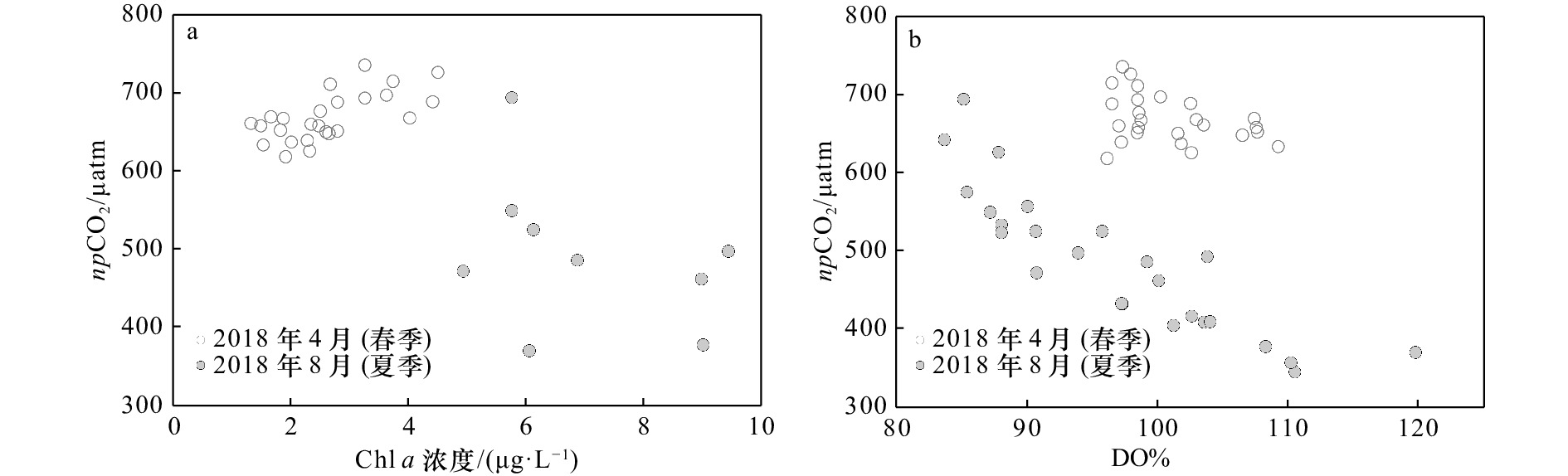
表 1 观测期间C1站水深、SST、SSS、DO浓度、Chl a浓度、DIC浓度、TA、pH和pCO2 统计结果
Tab. 1 Summary of water depth, SST, SSS, DO concentration, Chl a concentration, DIC concentration, TA, pH and pCO2 at Station C1 during the observations
观测时间 水深/m SST/℃ SSS DO浓度/
(μmol·L−1)Chl a浓度/
(μg·L−1)DIC浓度/
(μmol·kg−1)TA/
(μmol·kg−1)pH pCO2/μatm 2018年4月
8−9日
(春季)2.5~6.0 21.8~25.0 30.42~31.19 216.1~237.9 1.31~4.49 1 875~1 927 2 022~2098 7.99~8.05 530~628 (23.2±0.9) (30.81±0.19) (224.8±5.7) (2.62±0.88) (1 901±17) (2 063±22) (8.01±0.02) (588±27) 2018年8月25−26日
(夏季)4.5~8.8 28.0~31.3 21.73~27.34 179.2~242.8 4.92~9.44 1 569~1 729 1 661~1 895 7.88~8.12 427~748 (29.3±1.0) (24.51±1.53) (201.5±15.5) (6.99±1.60) (1 624±41) (1 772±70) (8.02±0.07) (548±83) 注:括号内为平均值±标准差。 表 2 观测期间C1站pCO2和相关环境因子Pearson相关性分析
Tab. 2 The Pearson correlations analysis of pCO2 and related environment factors at Station C1 during the observations
双因子 观测时间 2018年4月8−9日(春季) 2018年8月25−26日(夏季) 水深−pCO2 −0.872** −0.667** SST−pCO2 0.470* −0.782** SSS−pCO2 −0.840** −0.752** DO浓度−pCO2 0.298 −0.816** Chl a浓度−pCO2 0.435* −0.257 注:**代表p<0.01;*代表p<0.05。 表 3 观测期间C1站海−气ΔpCO2、风速和海−气CO2通量估算值统计结果
Tab. 3 Summary of sea-air ΔpCO2, wind speed and estimated sea-air CO2 flux at Station C1 during the observations
观测时间 ΔpCO2/
μatm风速U10/
(m·s−1)海−气CO2通量$F_{\rm CO_2} $/
(mmol·m−2·d−1)2018年4月
8−9日
(春季)140~238
(198±27)0.6~2.9
(1.9±0.5)0.2~4.0
(1.7±0.8)2018年8月
25−26日
(夏季)42~363
(163±83)0.2~3.4
(1.8±0.7)0~2.8
(1.2±0.8)注:括号中为平均值±标准差。 -
[1] Chen C T A, Borges A V. Reconciling opposing views on carbon cycling in the coastal ocean: continental shelves as sinks and near-shore ecosystems as sources of atmospheric CO2[J]. Deep-Sea Research Part II: Topical Studies in Oceanography, 2009, 56(8/10): 578−590. [2] Cai Weijun. Estuarine and coastal ocean carbon paradox: CO2 sinks or sites of terrestrial carbon incineration?[J]. Annual Review of Marine Science, 2011, 3: 123−145. doi: 10.1146/annurev-marine-120709-142723 [3] Chen C T A, Zhai Weidong, Dai Minhan. Riverine input and air-sea CO2 exchanges near the Changjiang (Yangtze River) Estuary: status quo and implication on possible future changes in metabolic status[J]. Continental Shelf Research, 2008, 28(12): 1476−1482. doi: 10.1016/j.csr.2007.10.013 [4] Zhai Weidong, Dai Minhan. On the seasonal variation of air-sea CO2 fluxes in the outer Changjiang (Yangtze River) Estuary, East China Sea[J]. Marine Chemistry, 2009, 117(1/4): 2−10. [5] Wang Bin, Chen Jianfang, Jin Haiyan, et al. Inorganic carbon parameters responding to summer hypoxia outside the Changjiang Estuary and the related implications[J]. Journal of Ocean University of China, 2013, 12(4): 568−576. doi: 10.1007/s11802-013-2239-0 [6] Yu Peisong, Zhang Haisheng, Zheng Minhui, et al. The partial pressure of carbon dioxide and air-sea fluxes in the Changjiang River Estuary and adjacent Hangzhou Bay[J]. Acta Oceanologica Sinica, 2013, 32(6): 13−17. doi: 10.1007/s13131-013-0320-6 [7] Wang Bin, Chen Jianfang, Jin Haiyan, et al. Diatom bloom-derived bottom water hypoxia off the Changjiang Estuary, with and without typhoon influence[J]. Limnology and Oceanography, 2017, 62(4): 1552−1569. doi: 10.1002/lno.10517 [8] Zhai Weidong, Yan Xiuli, Qi Di. Biogeochemical generation of dissolved inorganic carbon and nitrogen in the North Branch of inner Changjiang Estuary in a dry season[J]. Estuarine, Coastal and Shelf Science, 2017, 197: 136−149. doi: 10.1016/j.ecss.2017.08.027 [9] Dai Minhan, Zhai Weidong, Cai Weijun, et al. Effects of an estuarine plume-associated bloom on the carbonate system in the lower reaches of the Pearl River Estuary and the coastal zone of the northern South China Sea[J]. Continental Shelf Research, 2008, 28(12): 1416−1423. doi: 10.1016/j.csr.2007.04.018 [10] Guo Xianghui, Cai Weijun, Zhai Weidong, et al. Seasonal variations in the inorganic carbon system in the Pearl River (Zhujiang) Estuary[J]. Continental Shelf Research, 2008, 28(12): 1424−1434. doi: 10.1016/j.csr.2007.07.011 [11] Guo Xianghui, Dai Minhan, Zhai Weidong, et al. CO2 flux and seasonal variability in a large subtropical estuarine system, the Pearl River Estuary, China[J]. Journal of Geophysical Research: Biogeosciences, 2009, 114(G3): G03013. [12] Liu Zhiyuan, Zhang Longjun, Cai Weijun, et al. Removal of dissolved inorganic carbon in the Yellow River Estuary[J]. Limnology and Oceanography, 2014, 59(2): 413−426. doi: 10.4319/lo.2014.59.2.0413 [13] Li Xuegang, Song Jinming, Niu Lifeng, et al. Role of the Jiaozhou Bay as a source/sink of CO2 over a seasonal cycle[J]. Scientia Marina, 2007, 71(3): 441−450. doi: 10.3989/scimar.2007.71n3441 [14] Zhang Longjun, Xue Ming, Liu Qizhen. Distribution and seasonal variation in the partial pressure of CO2 during autumn and winter in Jiaozhou Bay, a region of high urbanization[J]. Marine Pollution Bulletin, 2012, 64(1): 56−65. doi: 10.1016/j.marpolbul.2011.10.023 [15] 龚信宝, 韩萍, 张龙军, 等. 胶州湾春季4月份表层海水pCO2分布及控制因素分析[J]. 中国海洋大学学报(自然科学版), 2015, 45(4): 95−102.Gong Xinbao, Han Ping, Zhang Longjun, et al. Distribution and controlling factors of sea surface partial pressure of CO2 in Jiaozhou Bay during April[J]. Periodical of Ocean University of China, 2015, 45(4): 95−102. [16] Li Yunxiao, Yang Xufeng, Han Ping, et al. Controlling mechanisms of surface partial pressure of CO2 in Jiaozhou Bay during summer and the influence of heavy rain[J]. Journal of Marine Systems, 2017, 173: 49−59. doi: 10.1016/j.jmarsys.2017.04.006 [17] 黄道建, 于锡军, 郭振仁, 等. 大亚湾表层水中溶解无机碳的时空分布[J]. 生态科学, 2013, 32(3): 331−337. doi: 10.3969/j.issn.1008-8873.2013.03.012Huang Daojian, Yu Xijun, Guo Zhenren, et al. Spatial-temporal distribution of dissolved inorganic carbon in surface waters of Daya Bay, China[J]. Ecological Science, 2013, 32(3): 331−337. doi: 10.3969/j.issn.1008-8873.2013.03.012 [18] 韩婷婷, 齐占会, 吴风霞, 等. 大亚湾不同海洋功能区表层海水无机碳体系的比较研究[J]. 热带海洋学报, 2016, 35(2): 57−65. doi: 10.11978/2015059Han Tingting, Qi Zhanhui, Wu Fengxia, et al. Comparative study of dissolved inorganic carbon systems of surface waters in various oceanic functional areas of Daya Bay[J]. Journal of Tropical Oceanography, 2016, 35(2): 57−65. doi: 10.11978/2015059 [19] Dai Minhan, Lu Zhongming, Zhai Weidong, et al. Diurnal variations of surface seawater pCO2 in contrasting coastal environments[J]. Limnology and Oceanography, 2009, 54(3): 735−745. doi: 10.4319/lo.2009.54.3.0735 [20] Ko Y H, Seok M W, Jeong J Y, et al. Monthly and seasonal variations in the surface carbonate system and air-sea CO2 flux of the Yellow Sea[J]. Marine Pollution Bulletin, 2022, 181: 113822. doi: 10.1016/j.marpolbul.2022.113822 [21] Shaw P T, Chao S Y. Surface circulation in the South China Sea[J]. Deep-Sea Research Part I: Oceanographic Research Papers, 1994, 41(11/12): 1663−1683. [22] Sun Hongliang, Huang Weimin. Three-dimensional numerical simulation for tide and tidal current in the Beibu Gulf[J]. Acta Oceanologica Sinica, 2001, 20(1): 29−38. [23] Hu Yuekai, Tian Bo, Yuan Lin, et al. Mapping coastal salt marshes in China using time series of Sentinel-1 SAR[J]. ISPRS Journal of Photogrammetry and Remote Sensing, 2021, 173: 122−134. doi: 10.1016/j.isprsjprs.2021.01.003 [24] Benson B B, Krause D Jr. The concentration and isotopic fractionation of oxygen dissolved in freshwater and seawater in equilibrium with the atmosphere1[J]. Limnology and Oceanography, 1984, 29(3): 620−632. doi: 10.4319/lo.1984.29.3.0620 [25] Dickson A G, Millero F J. A comparison of the equilibrium constants for the dissociation of carbonic acid in seawater media[J]. Deep Sea Research Part A. Oceanographic Research Papers, 1987, 34(10): 1733−1743. doi: 10.1016/0198-0149(87)90021-5 [26] Mehrbach C, Culberson C H, Hawley J E, et al. Measurement of the apparent dissociation constants of carbonic acid in seawater at atmospheric pressure[J]. Limnology and Oceanography, 1973, 18(6): 897−907. doi: 10.4319/lo.1973.18.6.0897 [27] Dickson A G. Standard potential of the reaction: AgCl(s) + 12H2(g) = Ag(s) + HCl(aq), and the standard acidity constant of the ion $ \rm HSO_4^- $ in synthetic seawater from 273.15 to 318.15 K[J]. The Journal of Chemical Thermodynamics, 1990, 22(2): 113−127. doi: 10.1016/0021-9614(90)90074-Z[28] Perez F F, Fraga F. Association constant of fluoride and hydrogen ions in seawater[J]. Marine Chemistry, 1987, 21(2): 161−168. doi: 10.1016/0304-4203(87)90036-3 [29] Lee K, Kim T W, Byrne R H, et al. The universal ratio of boron to chlorinity for the North Pacific and North Atlantic oceans[J]. Geochimica et Cosmochimica Acta, 2010, 74(6): 1801−1811. doi: 10.1016/j.gca.2009.12.027 [30] Ko Y H, Lee K, Eom K H, et al. Organic alkalinity produced by phytoplankton and its effect on the computation of ocean carbon parameters[J]. Limnology and Oceanography, 2016, 61(4): 1462−1471. doi: 10.1002/lno.10309 [31] Takahashi T, Sutherland S C, Sweeney C, et al. Global sea-air CO2 flux based on climatological surface ocean pCO2, and seasonal biological and temperature effects[J]. Deep-Sea Research Part II: Topical Studies in Oceanography, 2002, 49(9/10): 1601−1622. [32] Takahashi T, Olafsson J, Goddard J G, et al. Seasonal variation of CO2 and nutrients in the high-latitude surface oceans: a comparative study[J]. Global Biogeochemical Cycles, 1993, 7(4): 843−878. doi: 10.1029/93GB02263 [33] Weiss R F. Carbon dioxide in water and seawater: the solubility of a non-ideal gas[J]. Marine Chemistry, 1974, 2(3): 203−215. doi: 10.1016/0304-4203(74)90015-2 [34] Sweeney C, Gloor E, Jacobson A R, et al. Constraining global air-sea gas exchange for CO2 with recent bomb 14C measurements[J]. Global Biogeochemical Cycles, 2007, 21(2): GB2015. [35] Wanninkhof R. Relationship between wind speed and gas exchange over the ocean[J]. Journal of Geophysical Research: Oceans, 1992, 97(C5): 7373−7382. doi: 10.1029/92JC00188 [36] Liu Zilin, Cai Yuming, Ning Xiuren. Distribution characteristics of size-fractionated chlorophyll a and primary productivity in Beibu Gulf[J]. Acta Oceanologica Sinica, 1998, 17(1): 71−83. [37] Lu Zhongming, Gan Jianping, Dai Minhan. Modeling seasonal and diurnal pCO2 variations in the northern South China Sea[J]. Journal of Marine Systems, 2012, 92(1): 30−41. doi: 10.1016/j.jmarsys.2011.10.003 [38] Jones D C, Ito T, Takano Y, et al. Spatial and seasonal variability of the air-sea equilibration timescale of carbon dioxide[J]. Global Biogeochemical Cycles, 2014, 28(11): 1163−1178. doi: 10.1002/2014GB004813 [39] 黄广灵, 黄本胜, 邱静, 等. 英罗湾潮汐水道演变及其稳定性分析[J]. 中国农村水利水电, 2018(10): 27−31. doi: 10.3969/j.issn.1007-2284.2018.10.006Huang Guangling, Huang Bensheng, Qiu Jing, et al. The evolution and stability of the tidal channel of Yingluo Bay[J]. China Rural Water and Hydropower, 2018(10): 27−31. doi: 10.3969/j.issn.1007-2284.2018.10.006 [40] Zeebe R E, Wolf-Gladrow D. CO2 in Seawater: Equilibrium, Kinetics, Isotopes[M]. Amsterdam: Elsevier, 2001: 346. [41] Redfield A C, Ketchum B H, Richards F A. The influence of organisms on the composition of the sea water[M]//Hill M N. The Seas, Vol 2, The Composition of Sea-water: Comparative and Descriptive Oceanography. New York: Interscience Publishers, 1963: 26−77. [42] 黄广灵, 邱静, 陈晖. 英罗湾−安铺港沉积动力地貌特征及成因研究[J]. 广东水利水电, 2020(11): 52−57.Huang Guangling, Qiu Jing, Chen Hui. Submarine dynamic geomorphological characteristics and their formation cause in the Yingluo Bay-Anpu Harbor Area[J]. Guangdong Water Resources and Hydropower, 2020(11): 52−57. [43] Kaiser D, Unger D, Qiu Guanglong. Particulate organic matter dynamics in coastal systems of the northern Beibu Gulf[J]. Continental Shelf Research, 2014, 82: 99−118. doi: 10.1016/j.csr.2014.04.006 [44] Mcleod E, Chmura G L, Bouillon S, et al. A blueprint for blue carbon: toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2[J]. Frontiers in Ecology and the Environment, 2011, 9(10): 552−560. doi: 10.1890/110004 [45] 劳齐斌, 刘国强, 申友利, 等. 北部湾入海河流营养盐的分布特征及入海通量研究[J]. 海洋学报, 2020, 42(12): 93−100.Lao Qibin, Liu Guoqiang, Shen Youli, et al. Distribution characteristics and fluxes of nutrients in the rivers of the Beibu Gulf[J]. Haiyang Xuebao, 2020, 42(12): 93−100. [46] DeGrandpre M D, Hammar T R, Wallace D W R, et al. Simultaneous mooring-based measurements of seawater CO2 and O2 off Cape Hatteras, North Carolina[J]. Limnology and Oceanography, 1997, 42(1): 21−28. doi: 10.4319/lo.1997.42.1.0021 [47] Zhai Weidong, Chen Jianfang, Jin Haiyan, et al. Spring carbonate chemistry dynamics of surface waters in the northern East China Sea: water mixing, biological uptake of CO2, and chemical buffering capacity[J]. Journal of Geophysical Research: Oceans, 2014, 119(9): 5638−5653. doi: 10.1002/2014JC009856 [48] 翟惟东. 南海北部春季非水华期的CO2分压及其调控[J]. 海洋学报, 2015, 37(6): 31−40.Zhai Weidong. Sea surface partial pressure of CO2 and its controls in the northern South China Sea in the non-bloom period in spring[J]. Haiyang Xuebao, 2015, 37(6): 31−40. [49] Wang Songyin, Zhai Weidong. Regional differences in seasonal variation of air-sea CO2 exchange in the Yellow Sea[J]. Continental Shelf Research, 2021, 218: 104393. doi: 10.1016/j.csr.2021.104393 [50] 曹振轶, 鲍敏, 管卫兵, 等. 北部湾东北部水团分布及季节变化分析[J]. 海洋与湖沼, 2019, 50(3): 532−542. doi: 10.11693/hyhz20190100007Cao Zhenyi, Bao Min, Guan Weibing, et al. Water-mass evolution and the seasonal change in northeast of the Beibu Gulf, China[J]. Oceanologia et Limnologia Sinica, 2019, 50(3): 532−542. doi: 10.11693/hyhz20190100007 [51] Wang Z A, Cai Weijun. Carbon dioxide degassing and inorganic carbon export from a marsh-dominated estuary (the Duplin River): a marsh CO2 pump[J]. Limnology and Oceanography, 2004, 49(2): 341−354. doi: 10.4319/lo.2004.49.2.0341 [52] Chen C T A, Huang T H, Fu Yuhan, et al. Strong sources of CO2 in upper estuaries become sinks of CO2 in large river plumes[J]. Current Opinion in Environmental Sustainability, 2012, 4(4): 179−185. -




 下载:
下载: