Spatial distribution patterns of meiofauna and the influencing environmental factors in the southern Yellow Sea in summer and autumn
-
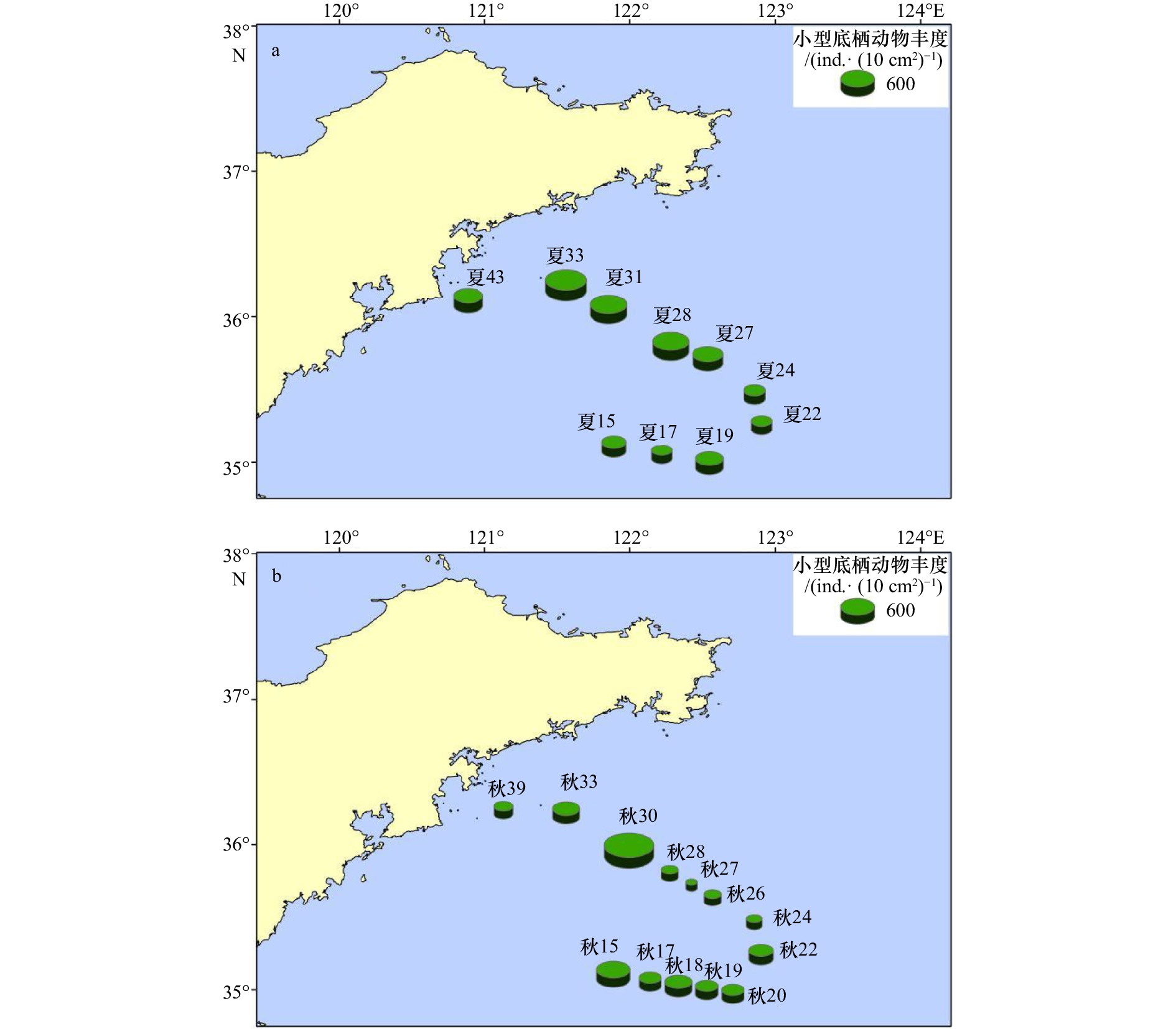
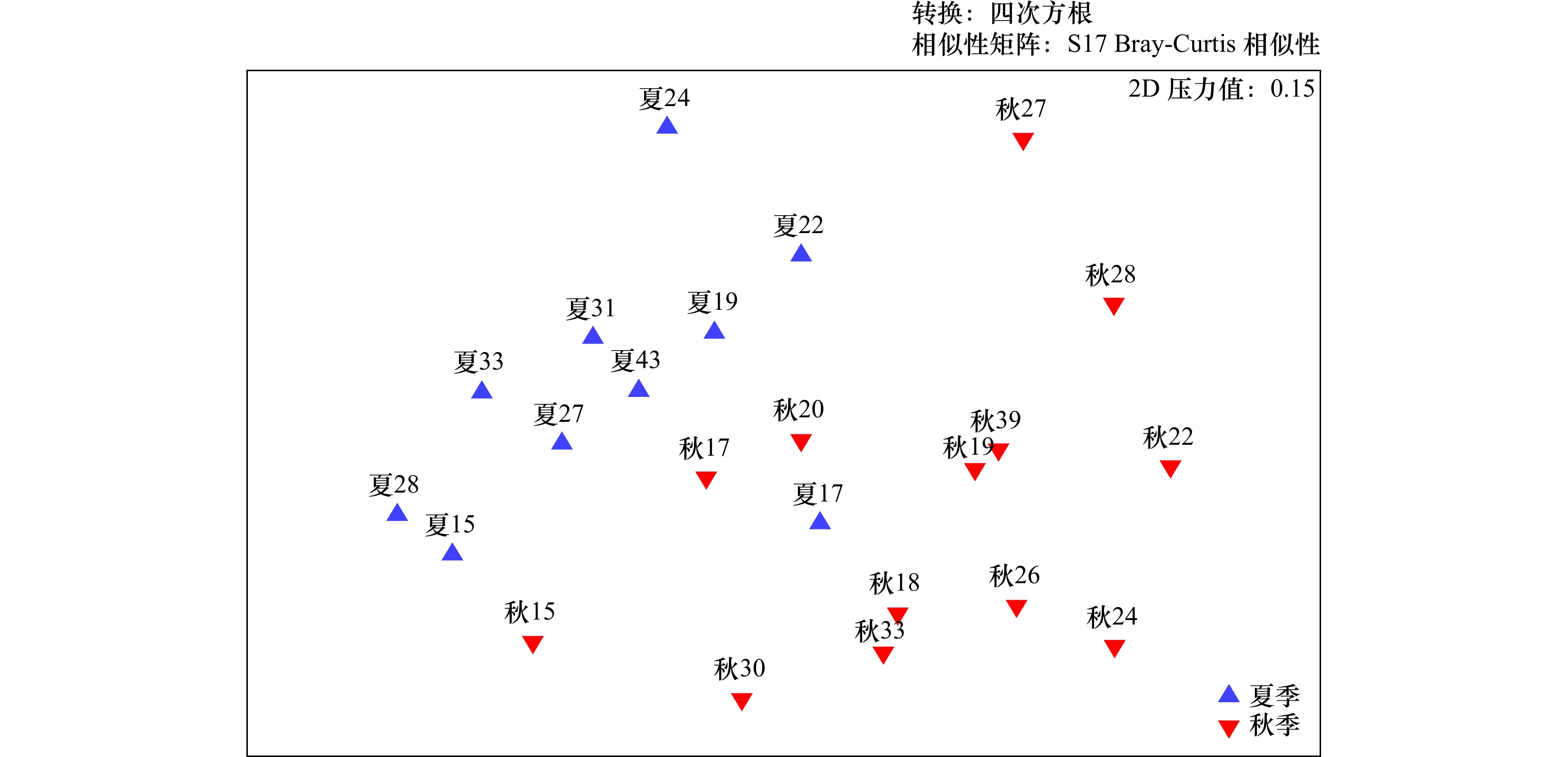
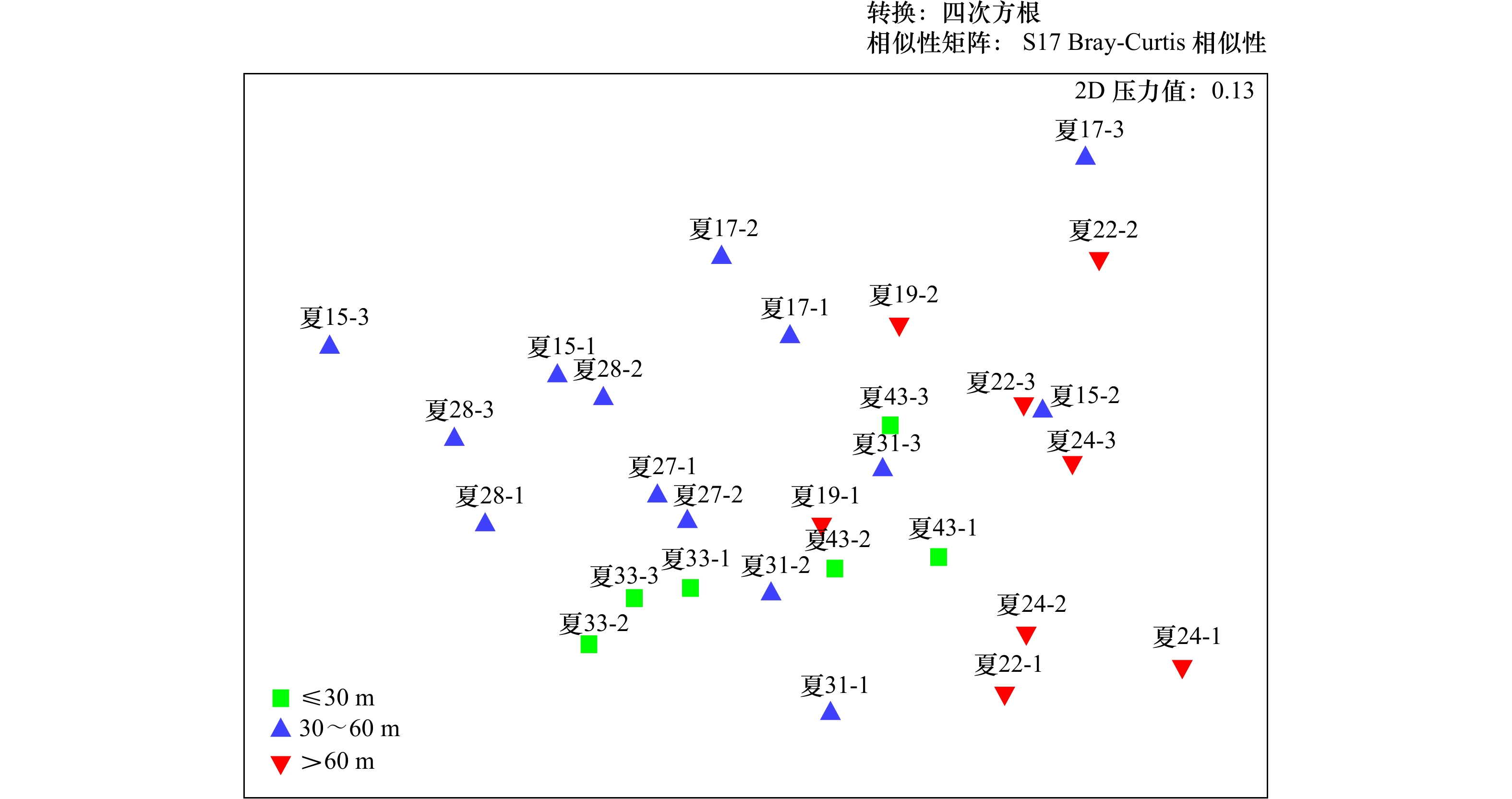
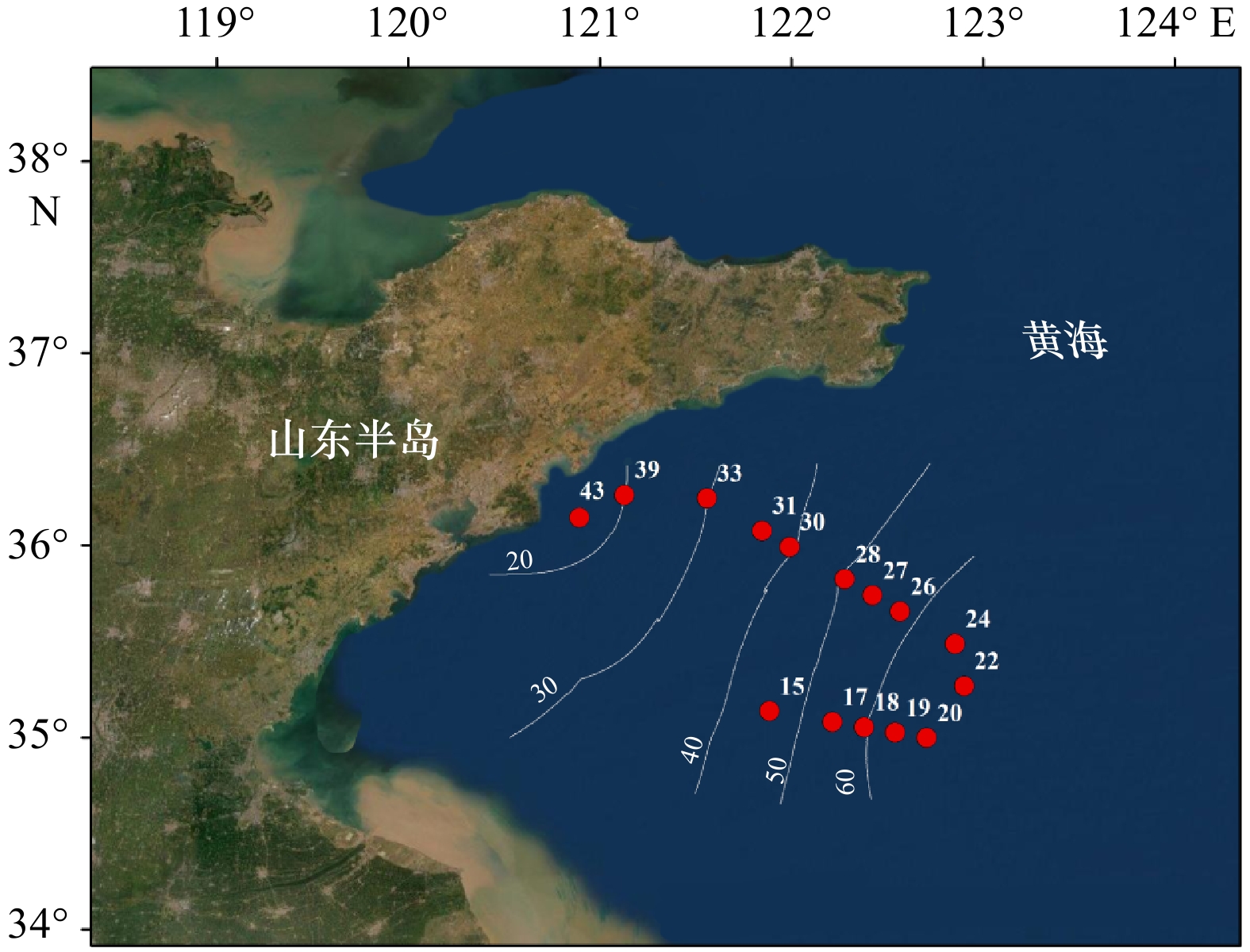
摘要: 为研究南黄海小型底栖动物的空间分布格局及其环境影响因素,于2020年8月(夏季)和11月(秋季)对南黄海进行了两个航次的野外观测和采样,对小型底栖动物的类群组成、丰度、生物量、垂直分布、群落结构及其与环境因子的关系进行了研究。结果显示,共鉴定出小型底栖动物类群15个,其中自由生活海洋线虫为最优势类群,在两个航次中分别占小型底栖动物总丰度的75.6%和84.6%。其他较重要的类群还包括底栖桡足类、轮虫类和枝角类等。夏季和秋季小型底栖动物的平均丰度分别为(514.9±32.1)ind./(10 cm2) 和(350.8±30.7)ind./(10 cm2),平均生物量(干质量)分别为(651.7±98.0)μg/(10 cm2)和(589.2±37.1)μg/(10 cm2)。小型底栖动物在时空分布上存在差异。在季节分布上,小型底栖动物丰度和类群组成存在极显著差异。结合环境因子分析结果可知,沉积物中值粒径是引起差异的主要环境因子。在空间分布上,夏季小型底栖动物丰度和类群组成在不同水深间存在极显著差异,秋季小型底栖动物丰度和类群组成在不同水深间差异不显著。推测黄海冷水团是影响夏季小型底栖动物空间分布差异的主要因素。本研究中小型底栖动物的数量和类群多样性相较于国内其他对南黄海小型底栖动物的研究较低,其中沉积物叶绿素a含量及有机质含量是引起南黄海小型底栖动物丰度变化的重要因素。海洋线虫与桡足类的丰度比值(N/C比值)评估显示秋季该区域存在有机污染,这一结果与应用大型底栖动物对同一区域进行环境评价的结果不一致,对于应用N/C比值评价环境质量还需要进一步的研究。Abstract: To study the spatial distribution patterns of meiofauna in the southern Yellow Sea and the influencing environmental factors, two cruises were conducted in the southern Yellow Sea in August (summer) and November (autumn) 2020 to analyze the taxa composition, abundance, biomass, vertical distribution, community structure of meiofauna and their relationship with environmental factors. The results showed that a total of 15 taxa of meiofauna were identified, among which free-living marine nematode was the most dominant group, accounting for 75.6% and 84.6% of the total abundance of meiofauna in the two cruises, respectively. Other important groups were benthic copepods, rotifers and cladocerans. The average abundance of meiofauna in summer and autumn was (514.9±32.1) ind./(10 cm2) and (350.8±30.7) ind./(10 cm2), and the average biomass (dry weight) was (651.7±98.0) μg/(10 cm2) and (589.2±37.1) μg/(10 cm2), respectively. There were differences both in the spatial and temporal distribution of meiofauna. In terms of seasonal distribution, highly significant differences were found in the abundance and taxa composition of meiofauna. Combined with the analysis results of environmental factors, the sediment median diameter was the main environmental factor causing the differences. In terms of spatial distribution, the abundance of meiofauna and community structure differed significantly along the water depth gradient in summer, while no significant differences were found along the water depth gradient in autumn. The Yellow Sea Cold Water Mass was supposed to be the main factor affecting the spatial distribution of meiofauna in summer. The abundance and taxa diversity of meiofauna in this study were lower compared with other studies on meiofauna in the southern Yellow Sea. The sediment chlorophyll a and organic matter contents were the important factors causing the change in abundance of meiofauna in the southern Yellow Sea. The assessment of the abundance ratio of marine nematodes to copepods (N/C ratio) showed the presence of organic pollution in the area in autumn, while this result was not consistent with that of the macrofaunal assemblages in the environmental quality evaluation of the same area, and further studies are needed for the application of N/C ratio to evaluate the environmental quality.
-
Key words:
- meiofauna /
- free-living marine nematodes /
- abundance /
- biomass /
- southern Yellow Sea
-
表 1 小型底栖动物各类群的个体平均干质量
Tab. 1 Individual average dry weight of different meiofauna groups
类群 平均干质量/μg 类群 平均干质量/μg 海洋线虫 Nematoda 0.4 动吻类 Kinorhyncha 2 桡足类 Copepoda 1.86 介形类 Ostracoda 26 枝角类 Cladocera 26 端足类 Amphipoda 15 轮虫类 Rotifera 3.5 等足类 Isopoda 15 海螨类 Halacaroidea 1.5 涟虫 Cumacea 3.5 涡虫类 Turbellaria 3.5 原足类 Tanaidacea 15 双壳类 Bivalvia 4.2 其他 Others 3.5 多毛类 Polychaeta 14 表 2 南黄海海域夏、秋季调查站位环境因子
Tab. 2 Environmental factors at the sampling sites in the southern Yellow Sea in summer and autumn
站位 WD/m SWT/℃ BWT/℃ BWS Md/mm YT/% W/% Chl a/(μg·g−1) Pha/(μg·g−1) OM/% 底质类型 夏15 41 22.70 10.55 32.22 0.08 42.94 29.81 0.26 1.05 0.53 粉砂质砂 夏17 53 22.24 11.09 32.77 0.01 66.60 45.50 0.23 1.16 0.80 砂−粉砂−黏土 夏19 62 22.37 10.83 32.99 0.02 63.96 45.06 0.10 0.55 0.70 砂−粉砂−黏土 夏22 70 24.05 11.15 32.10 0.02 59.40 49.53 0.32 1.56 1.91 砂−粉砂−黏土 夏24 63 21.76 11.03 33.11 0.01 59.46 52.36 0.51 1.80 3.18 砂−粉砂−黏土 夏27 51 23.23 10.58 32.63 0.02 55.70 51.47 0.50 2.19 2.67 砂−粉砂−黏土 夏28 52 23.63 11.16 32.43 0.01 76.00 49.36 0.28 1.26 2.60 砂−粉砂−黏土 夏31 34 23.51 14.15 32.09 0.01 80.18 39.26 0.29 1.31 1.39 黏土质粉砂 夏33 29 27.16 15.76 32.00 0.03 60.90 35.09 0.47 2.27 1.12 砂质粉砂 夏43 16 26.03 22.84 31.37 0.01 91.77 51.43 0.72 2.22 1.38 黏土质粉砂 秋15 47 17.61 17.85 31.86 0.12 30.15 34.95 0.16 0.69 1.08 粉砂质砂 秋17 53 14.97 14.78 32.00 0.14 32.05 48.90 0.09 0.67 3.02 粉砂质砂 秋18 60 16.11 13.99 32.08 0.11 39.92 49.91 0.03 0.16 2.08 粉砂质砂 秋19 63 19.01 12.72 32.34 0.12 36.74 49.37 0.38 2.26 0.63 粉砂质砂 秋20 67 16.90 11.00 32.97 0.08 46.57 51.15 1.15 7.39 2.36 粉砂质砂 秋22 68 16.19 11.00 32.97 0.19 25.57 51.05 0.17 1.06 0.67 粉砂质砂 秋24 67 17.95 11.02 32.89 0.09 42.25 55.66 0.35 1.49 2.74 粉砂质砂 秋26 57 17.11 12.02 32.45 0.19 24.81 51.16 0.14 0.77 1.96 砂 秋27 53 17.00 12.42 32.23 0.19 23.00 58.93 0.19 0.83 4.65 砂 秋28 51 16.21 17.82 31.66 0.15 30.31 54.65 0.12 0.60 1.63 粉砂质砂 秋30 39 12.34 18.14 31.60 0.10 39.63 43.48 0.14 0.56 0.90 粉砂质砂 秋33 30 18.26 17.85 31.74 0.13 33.27 40.40 0.07 0.40 1.11 粉砂质砂 秋39 20 18.01 17.42 31.60 0.01 92.75 47.30 0.37 1.25 1.30 黏土质粉砂 注:WD. 水深(water depth);SWT. 表层水温度(surface water temperature);BWT. 底层水温度(bottom water temperature);BWS. 底层水盐度(bottom water salinity);Md. 中值粒径(sediment median diameter);YT. 粉砂黏土含量(silt-clay percentage);W. 含水量(water content);Chl a. 叶绿素a含量(chlorophyll a content);Pha. 脱镁叶绿酸含量(phaeophorbide content);OM. 有机质含量(organic matter content)。 表 3 南黄海海域夏、秋季小型底栖动物各类群丰度和生物量
Tab. 3 Abundance and biomass of each meiofaunal group in the southern Yellow Sea in summer and autumn
类群 航次 丰度/
(ind.·(10 cm2)−1)丰度占
比/%生物量/
(μg·(10 cm2)−1)生物量
占比/%海洋线虫
Nematoda夏 389.2±18.4 75.6 155.7±7.3 23.9 秋 296.8±28.1 84.6 118.7±11.3 20.1 桡足类
Copepoda夏 67.2±16.1 13.1 125±29.9 19.2 秋 20.4±3.3 5.8 38±6.1 6.4 轮虫类
Rotifera夏 34.7±1.7 6.7 121.4±6.1 18.6 秋 10.7±0.5 3.1 37.5±1.8 6.4 枝角类
Cladocera夏 4.5±2 0.9 115.9±53.2 17.8 秋 11.6±0.5 3.3 301.9±13.7 51.2 涡虫类
Turbellaria夏 5.7±1.2 1.1 19.9±4.1 3.1 秋 3.3±0.6 0.9 11.4±2 1.9 多毛类
Polychaeta夏 1.9±0.8 0.4 26.7±11.4 4.1 秋 3.6±1.6 1.0 50.6±22.7 8.6 海螨类
Halacaroidea夏 3.4±0.6 0.7 5.2±0.9 0.8 秋 0.1±0.2 0 0.2±0.3 0 动吻类
Kinorhyncha夏 2.7±1.1 0.5 5.4±2.1 0.8 秋 0.9±0.1 0.3 1.7±0.3 0.3 双壳类
Bivalvia夏 2.3±0.9 0.4 9.6±3.9 1.5 秋 0.9±0.4 0.3 3.9±1.8 0.7 介形类
Ostracoda夏 1.9±1.2 0.4 48.6±31.6 7.5 秋 0.3±0.1 0.1 8.1±1.7 1.4 等足类
Isopoda夏 1.0±0.1 0.2 14.6±1.2 2.2 秋 0.5±0.1 0.1 7±1.7 1.2 涟虫
Cumacea夏 0.2±0.2 0 0.8±0.7 0.1 秋 0 0 0 0 端足类
Amphipoda夏 0.2±0.3 0 2.8±4.9 0.4 秋 0.1±0.1 0 1.7±1.7 0.3 原足类
Tanaidacea夏 0 0 0 0 秋 0.3±0.4 0.1 4.1±5.6 0.7 其他 夏 0.1±0.1 0 0.2±0.4 0 秋 1.2±0.6 0.3 4.3±1.9 0.7 合计 夏 514.9±32.1 100.0 651.7±98.0 100.0 秋 350.8±30.7 100.0 589.2±37.1 100.0 表 4 南黄海海域海洋线虫和桡足类丰度之比
Tab. 4 Ratios of abundance of nematodes to copepods in the southern Yellow Sea
站位 海洋线虫N 桡足类C N/C比值 站位 海洋线虫N 桡足类C N/C比值 夏季 15 246.4 80.3 3.1 秋季 15 462.0 60.6 7.6 17 209.5 37.4 5.6 17 251.4 11.1 22.6 19 338.5 59.8 5.7 18 322.1 25.2 12.8 22 200.4 45.4 4.4 19 217.1 17.2 12.6 24 142.4 106.0 1.3 20 225.7 24.7 9.1 27 441.5 50.0 8.8 22 320.1 6.1 52.8 28 559.4 108.1 5.2 24 130.8 10.1 13.0 31 597.3 74.7 8.0 26 122.7 13.6 9.0 33 742.7 81.3 9.1 27 72.2 5.0 14.3 43 404.4 26.3 15.4 28 166.6 3.5 47.1 30 1 080.0 44.9 24.0 33 346.9 20.7 16.8 39 140.9 22.7 6.2 表 5 南黄海夏、秋季小型底栖动物与环境因子的BIOENV分析
Tab. 5 Results of BIOENV analysis between meiofaunal assemblage and environmental factors in the southern Yellow Sea in summer and autumn
环境因子变量数 相关系数 环境因子变量组合 2 0.424 Md, W 3 0.419 Md, W, OM 4 0.378 YT, Md, W, OM 3 0.365 YT, Md, W 4 0.346 Md, W, OM, BWS 3 0.342 Md, W, BWS 5 0.331 YT, Md, W, OM, BWS 4 0.329 Md, W, OM, BWT 4 0.323 Md, W, OM, WD 3 0.320 YT, W, OM 注:WD. 水深(water depth);BWT. 底层水温度(bottom water temperature);BWS. 底层水盐度(bottom water salinity);Md. 中值粒径(sediment median diameter);YT. 粉砂黏土含量(silt-clay percentage);W. 含水量(water content);Chl a. 叶绿素a含量(chlorophyll a content);Pha. 脱镁叶绿酸含量(phaeophorbide content);OM. 有机质含量(organic matter content)。 表 6 南黄海夏、秋季小型底栖动物丰度、生物量与环境因子的相关分析结果
Tab. 6 Results of correlation analysis between abundance and biomass of meiofauna and environmental factors in the southern Yellow Sea in summer and autumn
WD/m BWT/℃ BWS Md/mm YT/% W/% Chl a/(μg·g−1) Pha/(μg·g−1) OM/% MA −0.417* 0.313 −0.297 −0.332 0.266 −0.531** −0.013 −0.06 −0.339 MB −0.345 0.301 −0.336 −0.257 0.195 −0.523* −0.074 −0.113 −0.309 MA' −0.417 0.187 −0.162 −0.482* 0.428* −0.590** 0.102 0.031 −0.294 MB' −0.314 0.197 −0.237 −0.336 0.286 −0.539** −0.001 −0.054 −0.257 注:**表示在0.01水平上显著相关;*表示在0.05水平上显著相关;WD. 水深(water depth);BWT. 底层水温度(bottom water temperature);BWS. 底层水盐度(bottom water salinity);Md. 中值粒径(sediment median diameter);YT. 粉砂黏土含量(silt-clay content);W. 含水量(water content);Chl a. 叶绿素a含量(chlorophyll a content);Pha. 脱镁叶绿酸含量(phaeophorbide content);OM. 有机质含量(organic matter content);MA. 小型底栖动物丰度(meiofauna abundance);MB. 小型底栖动物生物量(meiofauna biomass);MA'. 去除秋季30号站位的小型底栖动物丰度(meiofauna abundance without Site 30 in autumn);MB'. 去除秋季30号站位的小型底栖动物生物量(meiofauna biomass without Site 30 in autumn)。 表 7 南黄海小型底栖动物历史数据对比
Tab. 7 Comparison of historical data of meiofauna in the southern Yellow Sea
采样时间 小型底栖动物类群数 小型底栖动物丰度/(ind.·(10 cm2)−1) 海洋线虫占比/% 桡足类占比/% C/N比值 参考文献 2000年6月 18 809.3±407.4 73.8 18.7 3.9 文献[26] 2003年6月 18 1 584.0±686.0 88.7 5.8 16.2 文献[28] 2004年1月 20 1 186.1±486.1 89.77 4.2 21.4 文献[29] 2007年1−2月 15 348.8 77.6 13.3 13.1 文献[2] 2007年6月 18 1 529.0±1121.0 88.0 6.8 14.8 文献[30] 2011年6月 20 1 194.0±873.0 89.7 5.5 16.3 文献[31] 2013年6月 15 900.8±365.6 84.2 4.2 20.9 文献[32] 2013年11月 13 758.4±403.6 94.0 2.4 39.6 文献[32] 2020年8月 14 514.9±32.1 75.6 13.1 5.8 本研究 2020年11月 14 350.8±30.7 84.6 5.8 14.5 本研究 -
[1] 李新正. 我国海洋大型底栖生物多样性研究及展望: 以黄海为例[J]. 生物多样性, 2011, 19(6): 676−684.Li Xinzheng. An overview of studies on marine macrobenthic biodiversity from Chinese waters: principally from the Yellow Sea[J]. Biodiversity Science, 2011, 19(6): 676−684. [2] 范士亮, 王宗兴, 徐宗军, 等. 南黄海冬季小型底栖生物分布特征[J]. 海洋环境科学, 2011, 30(2): 185−188. doi: 10.3969/j.issn.1007-6336.2011.02.008Fan Shiliang, Wang Zongxing, Xu Zongjun, et al. Meiofauna distribution in southern Yellow Sea in winter[J]. Marine Environmental Science, 2011, 30(2): 185−188. doi: 10.3969/j.issn.1007-6336.2011.02.008 [3] 翁学传, 张以恳, 王从敏, 等. 黄海冷水团的变化特征[J]. 海洋与湖沼, 1988, 19(4): 368−379.Weng Xuechuan, Zhang Yiken, Wang Congmin, et al. The variational characteristics of the Huanghai Sea (Yellow Sea) cold water mass[J]. Oceanologia et Limnologia Sinica, 1988, 19(4): 368−379. [4] 任慧军, 詹杰民. 黄海冷水团的季节变化特征及其形成机制研究[J]. 水动力学研究与进展(A辑), 2005, 20(S1): 887−896.Ren Huijun, Zhan Jiemin. A numerical study on the seasonal variability of the Yellow Sea cold water mass and the related dynamics[J]. Journal of Hydrodynamics, 2005, 20(S1): 887−896. [5] 于非, 张志欣, 刁新源, 等. 黄海冷水团演变过程及其与邻近水团关系的分析[J]. 海洋学报, 2006, 28(5): 26−34.Yu Fei, Zhang Zhixin, Diao Xinyuan, et al. Analysis of evolution of the Huanghai Sea cold water mass and its relationship with adjacent water masses[J]. Haiyang Xuebao, 2006, 28(5): 26−34. [6] Yang Yang, Li Kuiping, Du Jianting, et al. Revealing the subsurface Yellow Sea cold water mass from satellite data associated with typhoon Muifa[J]. Journal of Geophysical Research: Oceans, 2019, 124(10): 7135−7152. doi: 10.1029/2018JC014727 [7] 蔡立哲. 海洋底栖生物生态学和生物多样性研究进展[J]. 厦门大学学报(自然科学版), 2006, 45(S2): 83−89.Cai Lizhe. Progress on marine benthic ecology and biodiversity[J]. Journal of Xiamen University (Natural Science), 2006, 45(S2): 83−89. [8] 张志南, 周红, 华尔, 等. 中国小型底栖生物研究的40年——进展与展望[J]. 海洋与湖沼, 2017, 48(4): 657−671.Zhang Zhinan, Zhou Hong, Hua Er, et al. Meiofauna study for the forty years in China—progress and prospect[J]. Oceanologia et Limnologia Sinica, 2017, 48(4): 657−671. [9] Zhao Meihong, Liu Qinghe, Zhang Dongsheng, et al. Deep-sea meiofauna assemblages with special reference to marine nematodes in the Caiwei Guyot and a Polymetallic Nodule Field in the Pacific Ocean[J]. Marine Pollution Bulletin, 2020, 160: 111564. doi: 10.1016/j.marpolbul.2020.111564 [10] Ptatscheck C, Gehner S, Traunspurger W. Should we redefine meiofaunal organisms? The impact of mesh size on collection of meiofauna with special regard to nematodes[J]. Aquatic Ecology, 2020, 54(4): 1135−1143. doi: 10.1007/s10452-020-09798-2 [11] 张志南, 周红. 国际小型底栖生物研究的某些进展[J]. 中国海洋大学学报(自然科学版), 2004, 34(5): 799−806.Zhang Zhinan, Zhou Hong. Some progress on the study of meiofauna[J]. Periodical of Ocean University of China, 2004, 34(5): 799−806. [12] Schratzberger M, Ingels J. Meiofauna matters: the roles of meiofauna in benthic ecosystems[J]. Journal of Experimental Marine Biology and Ecology, 2018, 502: 12−25. doi: 10.1016/j.jembe.2017.01.007 [13] van der Heijden L H, Niquil N, Haraldsson M, et al. Quantitative food web modeling unravels the importance of the microphytobenthos-meiofauna pathway for a high trophic transfer by meiofauna in soft-bottom intertidal food webs[J]. Ecological Modelling, 2020, 430: 109129. doi: 10.1016/j.ecolmodel.2020.109129 [14] Wang Fang, Lin Dunmei, Li Wei, et al. Meiofauna promotes litter decomposition in stream ecosystems depending on leaf species[J]. Ecology and Evolution, 2020, 10(17): 9257−9270. doi: 10.1002/ece3.6610 [15] Fonseca V G, Sinniger F, Gaspar J M, et al. Revealing higher than expected meiofaunal diversity in Antarctic sediments: a metabarcoding approach[J]. Scientific Reports, 2017, 7(1): 6094. doi: 10.1038/s41598-017-06687-x [16] Schratzberger M, Somerfield P J. Effects of widespread human disturbances in the marine environment suggest a new agenda for meiofauna research is needed[J]. Science of the Total Environment, 2020, 728: 138435. doi: 10.1016/j.scitotenv.2020.138435 [17] 郭玉清, 张志南, 慕芳红. 渤海海洋线虫与底栖桡足类数量之比的应用研究[J]. 海洋科学, 2002, 26(12): 27−31. doi: 10.3969/j.issn.1000-3096.2002.12.008Guo Yuqing, Zhang Zhinan, Mu Fanghong. The study on the ratio of abundance of nema-todes to that of copepods in the Bohai Sea[J]. Marine Sciences, 2002, 26(12): 27−31. doi: 10.3969/j.issn.1000-3096.2002.12.008 [18] Janakiraman A, Naveed M S, Asrar Sheriff M, et al. Ecological restoration assessment of Adyar creek and estuary using meiofaunal communities as ecological indicators for aquatic pollution[J]. Regional Studies in Marine Science, 2017, 9: 135−144. doi: 10.1016/j.rsma.2016.12.001 [19] 刘清河, 马林, 李新正. 东海北部小型底栖动物群落对径流及黑潮暖流入侵的响应[J]. 海洋学报, 2020, 42(2): 52−64.Liu Qinghe, Ma Lin, Li Xinzheng. The communities of meiofauna in the northern East China Sea and their responses to runoff and the intrusion of Kuroshio Current[J]. Haiyang Xuebao, 2020, 42(2): 52−64. [20] Danovaro R, Fraschetti S. Meiofaunal vertical zonation on hard-bottoms: comparison with soft-bottom meiofauna[J]. Marine Ecology Progress Series, 2002, 230: 159−169. doi: 10.3354/meps230159 [21] Lins L, Leliaert F, Riehl T, et al. Evaluating environmental drivers of spatial variability in free-living nematode assemblages along the Portuguese margin[J]. Biogeosciences, 2017, 14(3): 651−669. doi: 10.5194/bg-14-651-2017 [22] Kim H G, Song S J, Bae H, et al. Natural and anthropogenic impacts on long-term meiobenthic communities in two contrasting nearshore habitats[J]. Environment International, 2020, 134: 105200. doi: 10.1016/j.envint.2019.105200 [23] Sevastou K, Lampadariou N, Mouriki D, et al. Meiofaunal distribution in the Levantine Basin (Eastern Mediterranean): spatial variability at different scales, depths and distance-to-coast[J]. Deep-Sea Research Part II: Topical Studies in Oceanography, 2020, 171: 104635. doi: 10.1016/j.dsr2.2019.104635 [24] 陈海燕, 周红, 慕芳红, 等. 北黄海小型底栖生物丰度和生物量时空分布特征[J]. 中国海洋大学学报(自然科学版), 2009, 39(4): 657−663.Chen Haiyan, Zhou Hong, Mu Fanghong, et al. The spatial-temporal distributional characteristics of meiobenthic abundance and biomass in the northern Yellow Sea[J]. Periodical of Ocean University of China, 2009, 39(4): 657−663. [25] 于青, 周红, 张凯, 等. 北黄海冷水团对小型底栖动物时空分布的影响[J]. 中国海洋大学学报(自然科学版), 2016, 46(12): 60−67.Yu Qing, Zhou Hong, Zhang Kai, et al. Effects of the northern Yellow Sea cold water mass on the spatio-temporal distribution of meiofauna[J]. Periodical of Ocean University of China, 2016, 46(12): 60−67. [26] 张志南, 慕芳红, 于子山, 等. 南黄海鳀鱼产卵场小型底栖生物的丰度和生物量[J]. 青岛海洋大学学报, 2002, 32(2): 251−258.Zhang Zhinan, Mu Fanghong, Yu Zishan, et al. Abundance and biomass of the benthic meiofauna in the spawning ground of anchovy (Engraulis japanicus) in the southern Yellow Sea, China[J]. Journal of Ocean University of Qingdao, 2002, 32(2): 251−258. [27] 黄勇. 南黄海小型底栖生物生态学和海洋线虫分类学研究[D]. 青岛: 中国海洋大学, 2005.Huang Yong. Studies on ecology of meiofauna and systematics of free-living marine nematodes in the southern Yellow Sea, China[D]. Qingdao: Ocean University of China, 2005. [28] Liu Xiaoshou, Zhang Zhinan, Huang Yong. Abundance and biomass of meiobenthos in the spawning ground of anchovy (Engraulis japanicus) in the southern Huanghai Sea[J]. Acta Oceanologica Sinica, 2005, 24(3): 94−104. [29] 张艳, 张志南, 华尔. 南黄海小型底栖动物分布及其与环境因子的关系[J]. 中国农学通报, 2009, 25(19): 323−329.Zhang Yan, Zhang Zhinan, Hua Er. Relationship between distribution of meiofauna and environmental factors in southern Yellow Sea[J]. Chinese Agricultural Science Bulletin, 2009, 25(19): 323−329. [30] 王家栋, 类彦立, 徐奎栋, 等. 黄海冷水团及周边海域夏初小型底栖动物现存量及空间分布研究[J]. 海洋与湖沼, 2011, 42(3): 359−366. doi: 10.11693/hyhz201103004004Wang Jiadong, Lei Yanli, Xu Kuidong, et al. An investigation on the biomass, abundance and distribution of meiofauna under the cold water mass and its surrounding areas of the Yellow Sea[J]. Oceanologia et Limnologia Sinica, 2011, 42(3): 359−366. doi: 10.11693/hyhz201103004004 [31] 刘清河, 刘晓收, 许嫚, 等. 夏季南黄海冷水团及其周边海域小型底栖动物类群组成与分布[J]. 生态学报, 2015, 35(24): 8062−8074.Liu Qinghe, Liu Xiaoshou, Xu Man, et al. Meiofaunal assemblage and distribution in the southern Yellow Sea cold water mass and its adjacent waters in summer[J]. Acta Ecologica Sinica, 2015, 35(24): 8062−8074. [32] 许嫚, 刘晓收, 刘清河, 等. 夏秋季南黄海冷水团小型底栖动物类群组成与分布[J]. 应用生态学报, 2015, 26(2): 616−624.Xu Man, Liu Xiaoshou, Liu Qinghe, et al. Assemblage composition and distribution of meiofauna in the southern Yellow Sea cold water mass during summer and autumn[J]. Chinese Journal of Applied Ecology, 2015, 26(2): 616−624. [33] Xu Man, Liu Qinghe, Zhang Zhinan, et al. Response of free-living marine nematodes to the southern Yellow Sea cold water mass[J]. Marine Pollution Bulletin, 2016, 105(1): 58−64. doi: 10.1016/j.marpolbul.2016.02.067 [34] Widbom B. Determination of average individual dry weights and ash-free dry weights in different sieve fractions of marine meiofauna[J]. Marine Biology, 1984, 84(1): 101−108. doi: 10.1007/BF00394532 [35] 张志南, 周红, 于子山, 等. 胶州湾小型底栖生物的丰度和生物量[J]. 海洋与湖沼, 2001, 32(2): 139−147.Zhang Zhinan, Zhou Hong, Yu Zishan, et al. Abundance and biomass of the benthic meiofauna in the northern soft-bottom of the Jiaozhou Bay[J]. Oceanologia et Limnologia Sinica, 2001, 32(2): 139−147. [36] 赵美红, 刘晓收. 山东半岛沿岸潮间带小型底栖动物类群组成与分布格局[J]. 聊城大学学报(自然科学版), 2021, 34(5): 100−110. doi: 10.19728/j.issn1672-6634.2021.05.013Zhao Meihong, Liu Xiaoshou. Taxa composition and distribution patterns of meiofauna in the intertidal zones of Shandong Peninsula[J]. Journal of Liaocheng University (Natural Science), 2021, 34(5): 100−110. doi: 10.19728/j.issn1672-6634.2021.05.013 [37] Baia E, Venekey V. Distribution patterns of meiofauna on a tropical macrotidal sandy beach, with special focus on nematodes (Caixa d’Água, Amazon Coast, Brazil)[J]. Brazilian Journal of Oceanography, 2019, 67: e19230. doi: 10.1590/s1679-87592019023006701 [38] 慕芳红, 张婷, 李佳, 等. 厦门大德记沙滩小型底栖动物的时空分布及影响因素[J]. 中国海洋大学学报(自然科学版), 2020, 50(9): 34−45.Mu Fanghong, Zhang Ting, Li Jia, et al. Spatiotemporal distribution of meiofauna and its influencing factors at the Dadeji Beach, Xiamen[J]. Periodical of Ocean University of China, 2020, 50(9): 34−45. [39] 臧瑜, 孙燕, 杨丽莉, 等. 大连金沙滩小型底栖生物时空分布特征及影响因素[J]. 海洋科学, 2020, 44(2): 76−89. doi: 10.11759/hykx20190115002Zang Yu, Sun Yan, Yang Lili, et al. Spatiotemporal distribution pattern of meiofauna and its influencing factors in the Jinshatan Beach, Dalian[J]. Marine Sciences, 2020, 44(2): 76−89. doi: 10.11759/hykx20190115002 [40] 卢健, 李安春. 南黄海表层沉积物粒度特征季节变化及其影响因素[J]. 海洋科学, 2015, 39(3): 48−58. doi: 10.11759/hykx20140527001Lu Jian, Li Anchun. Seasonal variations and influencing factors of the grain size characteristics of surface sediments in the South Yellow Sea[J]. Marine Sciences, 2015, 39(3): 48−58. doi: 10.11759/hykx20140527001 [41] Lu Jian, Li Anchun, Huang Peng, et al. Mineral distributions in surface sediments of the western South Yellow Sea: implications for sediment provenance and transportation[J]. Chinese Journal of Oceanology and Limnology, 2015, 33(2): 510−524. doi: 10.1007/s00343-015-4106-x [42] Lu Jing, Qiao Fangli, Wang X H, et al. A numerical study of transport dynamics and seasonal variability of the Yellow River sediment in the Bohai and Yellow seas[J]. Estuarine, Coastal and Shelf Science, 2011, 95(1): 39−51. doi: 10.1016/j.ecss.2011.08.001 [43] 慕芳红, 张志南, 郭玉清. 渤海小型底栖生物的丰度和生物量[J]. 青岛海洋大学学报, 2001, 31(6): 897−905.Mu Fanghong, Zhang Zhinan, Guo Yuqing. Abundance and biomass of the benthic meiofauna in the Bohai Sea[J]. Journal of Ocean University of Qingdao, 2001, 31(6): 897−905. [44] 杨纯懿, 张龙辉, 杜永芬, 等. 双台子河口砂质潮间带小型底栖动物的群落结构及其对环境的响应[J]. 海洋与湖沼, 2020, 51(3): 572−582. doi: 10.11693/hyhz20191000202Yang Chunyi, Zhang Longhui, Du Yongfen, et al. Meiofaunal community in sandy intertidal zone and its environmental response in Shuangtaizi Estuary, NE China[J]. Oceanologia et Limnologia Sinica, 2020, 51(3): 572−582. doi: 10.11693/hyhz20191000202 [45] Ingels J, dos Santos G, Hicks N, et al. Short-term CO2 exposure and temperature rise effects on metazoan meiofauna and free-living nematodes in sandy and muddy sediments: results from a flume experiment[J]. Journal of Experimental Marine Biology and Ecology, 2018, 502: 211−226. doi: 10.1016/j.jembe.2017.07.012 [46] 贾素素, 乔春艳, 黄勇. 南海东北部夏季小型底栖生物研究[J]. 海洋与湖沼, 2020, 51(3): 564−571. doi: 10.11693/hyhz20191100216Jia Susu, Qiao Chunyan, Huang Yong. Study on summer meiofauna in the northeastern South China Sea[J]. Oceanologia et Limnologia Sinica, 2020, 51(3): 564−571. doi: 10.11693/hyhz20191100216 [47] 宋慧丽, 慕芳红, 孙燕, 等. 冬季大连砂质潮间带自由生活海洋线虫群落结构及多样性的比较[J]. 海洋学报, 2021, 43(8): 139−151.Song Huili, Mu Fanghong, Sun Yan, et al. Comparison of community structure and diversity of free-living marine nematodes in the sandy intertidal zone of Dalian in winter[J]. Haiyang Xuebao, 2021, 43(8): 139−151. [48] Li Wenjian, Wang Zhenyan, Huang Haijun. Relationship between the southern Yellow Sea cold water mass and the distribution and composition of suspended particulate matter in summer and autumn seasons[J]. Journal of Sea Research, 2019, 154: 101812. doi: 10.1016/j.seares.2019.101812 [49] 张启龙, 翁学传, 杨玉玲. 南黄海春季水团分析[J]. 海洋与湖沼, 1996, 27(4): 421−428. doi: 10.3321/j.issn:0029-814X.1996.04.013Zhang Qilong, Weng Xuechuan, Yang Yuling. Analysis of water masses in the South Yellow Sea in spring[J]. Oceanologia et Limnologia Sinica, 1996, 27(4): 421−428. doi: 10.3321/j.issn:0029-814X.1996.04.013 [50] Gambi C, Carugati L, Lo Martire M, et al. Biodiversity and distribution of meiofauna in the Gioia, Petrace and Dohrn Canyons (Tyrrhenian Sea)[J]. Progress in Oceanography, 2019, 171: 162−174. doi: 10.1016/j.pocean.2018.12.016 [51] 蒲思潮, 史本泽, 徐奎栋. 西北太平洋深海小型底栖生物群落结构与分布特点初探[J]. 海洋与湖沼, 2020, 51(3): 547−554. doi: 10.11693/hyhz20191200265Pu Sichao, Shi Benze, Xu Kuidong. Community structure and distribution of meiofauna in deep-sea areas of the northwestern Pacific Ocean[J]. Oceanologia et Limnologia Sinica, 2020, 51(3): 547−554. doi: 10.11693/hyhz20191200265 [52] 贾海波, 曹柳燕, 柴小平. 2016−2019年夏季长江口海域大型底栖动物群落结构的变化及其原因分析[J]. 海洋环境科学, 2022, 41(2): 180−186. doi: 10.13634/j.cnki.mes.2022.02.015Jia Haibo, Cao Liuyan, Chai Xiaoping. The changes of macrobenthic community structure and cause analysis in the Yangtze Estuary during summer from 2016 to 2019[J]. Marine Environmental Science, 2022, 41(2): 180−186. doi: 10.13634/j.cnki.mes.2022.02.015 [53] 周红, Uddin S M D, 黄梦娇, 等. 南海北部陆架和陆坡区小型底栖动物群落的比较研究[J]. 海洋与湖沼, 2020, 51(3): 555−563. doi: 10.11693/hyhz20191100228Zhou Hong, Uddin S M D, Huang Mengjiao, et al. Comparison in meiofaunal communities between shelf and slope of the northern South China Sea[J]. Oceanologia et Limnologia Sinica, 2020, 51(3): 555−563. doi: 10.11693/hyhz20191100228 [54] Raffaelli D G, Mason C F. Pollution monitoring with meiofauna, using the ratio of nematodes to copepods[J]. Marine Pollution Bulletin, 1981, 12(5): 158−163. doi: 10.1016/0025-326X(81)90227-7 [55] 蒲思潮, 史本泽, 张光涛, 等. 莱州湾和牟平近海夏季小型底栖生物群落组成及环境状况分析[J]. 海洋科学, 2018, 42(4): 101−111. doi: 10.11759/hykx201801220001Pu Sichao, Shi Benze, Zhang Guangtao, et al. Meiofaunal community structure and environmental conditions in Laizhou Bay and the Muping offshore area in summer[J]. Marine Sciences, 2018, 42(4): 101−111. doi: 10.11759/hykx201801220001 [56] Warwick R M. The nematode/copepod ratio and its use in pollution ecology[J]. Marine Pollution Bulletin, 1981, 12(10): 329−333. doi: 10.1016/0025-326X(81)90105-3 [57] Xu Jing, Lu Xin, Liu Xiaoshou. Patterns of species and functional diversity of macrofaunal assemblages and the bioassessment of benthic ecological quality status in the southern Yellow Sea[J]. Marine Pollution Bulletin, 2021, 171: 112784. doi: 10.1016/j.marpolbul.2021.112784 -
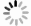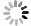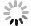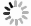



 下载:
下载: