Study on cell classificatioin, immune-related enzymatic characteristics and preliminary transcriptome of coelomocytes in Onchidium struma
-
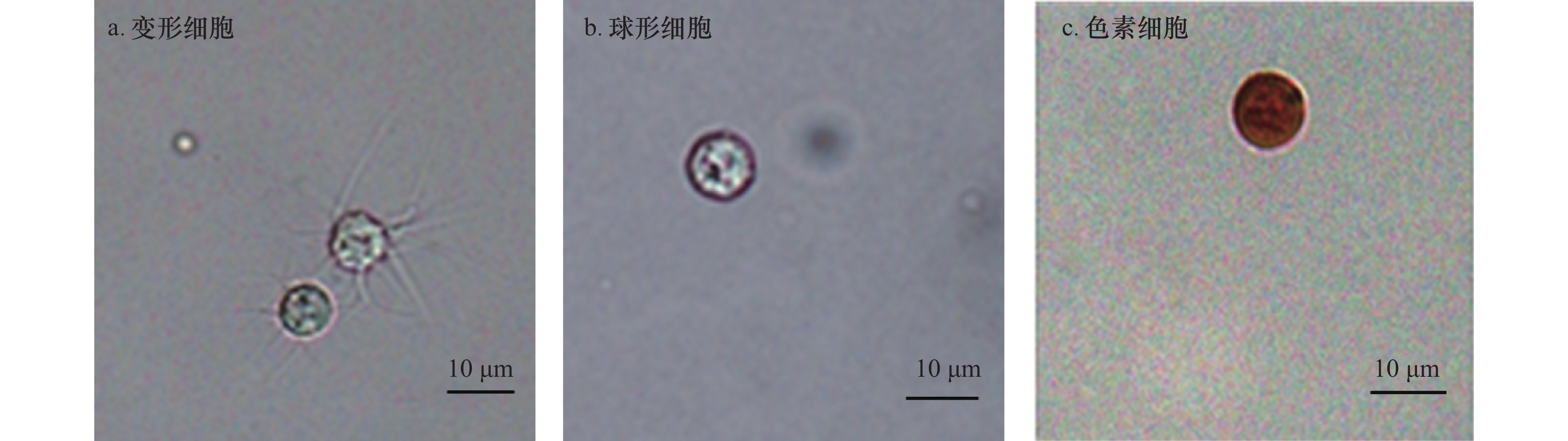
摘要: 瘤背石磺(Onchidium struma)广泛分布于潮间带和潮下带,是海洋生物向陆地生物辐射进化的重要代表,也是环境监测的指示生物。为丰富瘤背石磺的基础免疫学资料,本文研究了瘤背石磺体腔细胞的类别、细胞密度和体腔液免疫相关酶活性,并通过RNA-Seq测序获得体腔细胞转录本,进行生物信息学分析。结果表明,瘤背石磺主要有变形细胞、球形细胞和色素细胞3种不同类型的体腔细胞,其中,球形细胞数量最多,色素细胞数量最少;在无任何外源刺激下,体腔液内酸性磷酸酶、碱性磷酸酶、超氧化物歧化酶和酚氧化酶等抗氧化酶和免疫相关酶均具有活性,且超氧化物歧化酶和酚氧化酶活性最高;转录组学分析显示,体腔细胞中共组装出63 097个Unigenes,KEGG将这些Unigenes主要注释到“信号转导” “运输和分解代谢” “内分泌系统” “翻译” “折叠、分选和降解”等信号通路。研究结果将利于进一步揭示瘤背石磺的体腔液及其体腔细胞在机体免疫防御过程中的作用,丰富瘤背石磺的基础免疫学资料。Abstract: Onchidium struma is widely distributed in intertidal zone and subtidal zone, and considered as a representative species of evolution from ocean to land and an indicator organism for evaluation of environment quality. To enrich the basic immunological data of O. struma, the classification of coelomocytes, cell density and immune-related enzyme activity of the coelomic fluid are studied, and also transcriptome analysis is performed by RNA-Seq sequencing. The results show that there are three different types of coelomocytes, including amoebocytes, spherulocytes and chromatocytes. The number of coelomocytes from more to less are spherulocytes, amoebocytes, chromatocytes. The higher enzyme activities including acid phosphatase (ACP), alkaline phosphatase (AKP), superoxide dismutase (SOD) and polyphenol oxidase (PO), are detected in coelomic fluids. The activities of SOD and PO are highest. Based on De novo transcriptome analysis, a total of 63 097 unigenes are assembled. KEGG annotations of these unigenes are mostly enriched in “signal transduction” “transport and catabolism” “endocrine system” “translation” “folding, sorting and degradation”, and signalling pathways. The present results will be helpful to further reveal the important role of the body cavity fluid and body coelomocytes in the host immune defense, and enrich the basic immunological data of O. struma.
-
Key words:
- Onchidium struma /
- coelomic fluid /
- coelomocytes /
- immune-related enzymes /
- transcriptome analysis
-
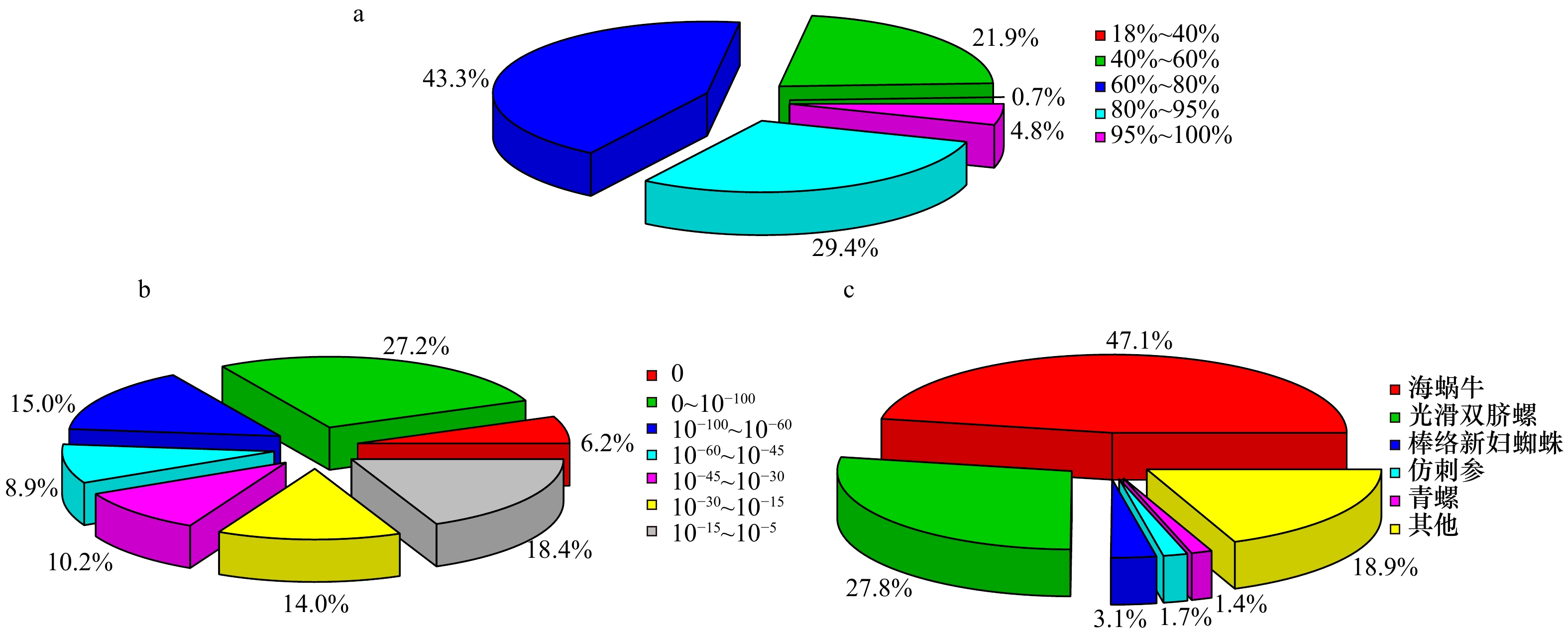
图 4 瘤背石磺体腔细胞转录本序列与数据库中已知序列比对结果
a. 基于Nr分析每个Unigenes的相似性分布;b. E值分布;c. 物种相似率分布
Fig. 4 Comparison of transcriptomic sequences from coelomocytes in Onchidium struma with the known sequences from different species in database
a. Analyze the similarity distribution of each unigenes based on Nr database; b. E-value distribution; c. species similarity rate distribution for each Unigene
表 1 瘤背石磺体腔细胞6个文库的序列统计
Tab. 1 Statistics of transcriptomic sequences from six libraries formed from coelomocytes of Onchidium struma
样本 原始测序数据 过滤后数据 过滤后
碱基数错误率/
%Q20值/
%Q30值/
%GC含量/
%C_1 56 905 466 55 196 240 8.28G 0.03 97.45 92.82 39.69 C_2 53 789 348 52 602 114 7.89G 0.03 97.54 92.96 40.95 C_3 52 255 816 49 929 942 7.49G 0.03 97.54 92.97 39.96 C_4 55 152 332 53 717 116 8.06G 0.03 97.61 93.13 40.92 C_5 55 111 052 53 356 160 8.00G 0.03 97.27 92.39 41.54 C_6 55 545 304 53 926 240 8.09G 0.03 97.66 93.24 40.93 均值 54 793 220 53 121 302 7.97G 0.03 97.51 92.91 40.66 -
[1] 黄金田, 王爱民. 瘤背石磺营养成分分析及品质评价[J]. 海洋科学, 2008, 32(11): 29−35.Huang Jintian, Wang Aimin. Determination of the nutrients of Onchidium struma and evaluation of its quality[J]. Marine Sciences, 2008, 32(11): 29−35. [2] 史艳梅, 黄笑含, 杨铁柱, 等. 瘤背石磺代谢蛋白PAK2基因的克隆、相对表达量及进化分析[J]. 安徽农业大学学报, 2020, 47(2): 179−184.Shi Yanmei, Huang Xiaohan, Yang Tiezhu, et al. Clone and relative of PAK2 to discuss the evolutionary relationship in Onchidium reevesii[J]. Journal of Anhui Agricultural University, 2020, 47(2): 179−184. [3] Klussmann-Kolb A, Dinapoli A, Kuhn K, et al. From sea to land and beyond-new insights into the evolution of euthyneuran Gastropoda (Mollusca)[J]. BMC Evolutionary Biology, 2008, 8: 57. doi: 10.1186/1471-2148-8-57 [4] Kwan B K Y, Chan A K Y, Cheung S G, et al. Responses of growth and hemolymph quality in juvenile Chinese horseshoe crab Tachypleus tridentatus (Xiphosura) to sublethal tributyltin and cadmium[J]. Ecotoxicology, 2015, 24(9): 1880−1895. doi: 10.1007/s10646-015-1524-7 [5] 黄金田, 张余霞. 瘤背石磺室内温箱养殖试验[J]. 海洋科学, 2004, 28(10): 14−16. doi: 10.3969/j.issn.1000-3096.2004.10.004Huang Jintian, Zhang Yuxia. Indoor cultivation experiment of Onchidium struma in warm box[J]. Marine Science, 2004, 28(10): 14−16. doi: 10.3969/j.issn.1000-3096.2004.10.004 [6] Dang C, Lambert C, Soudant P, et al. Immune parameters of QX-resistant and wild caught Saccostrea glomerata hemocytes in relation to Marteilia sydneyi infection[J]. Fish & Shellfish Immunology, 2011, 31(6): 1034−1040. [7] Hégaret H, Wikfors G H, Soudant P. Flow cytometric analysis of haemocytes from eastern oysters, Crassostrea virginica, subjected to a sudden temperature elevation[J]. Journal of Experimental Marine Biology and Ecology, 2003, 293(2): 249−265. doi: 10.1016/S0022-0981(03)00235-1 [8] Nguyen T V, Alfaro A C, Merien F, et al. In vitro study of apoptosis in mussel (Perna canaliculus) haemocytes induced by lipopolysaccharide[J]. Aquaculture, 2019, 503: 8−15. doi: 10.1016/j.aquaculture.2018.12.086 [9] Zhang Mingming, Qiao Guo, Li Qiang, et al. Transcriptome analysis and discovery of genes involved in immune pathways from coelomocytes of Onchidium struma after bacterial challenge[J]. Fish & Shellfish Immunology, 2018, 72: 528−543. [10] 任媛, 李强, 王轶南, 等. 棘皮动物体腔细胞的研究进展[J]. 中国农业科技导报, 2019, 21(2): 91−97.Ren Yuan, Li Qiang, Wang Yi’nan, et al. Research advances on coelomocyte of Echinodermata[J]. Journal of Agricultural Science and Technology, 2019, 21(2): 91−97. [11] 丁君, 常亚青, 王长海, 等. 不同种海胆体腔细胞类型及体液中的酶活力[J]. 中国水产科学, 2006, 13(1): 33−38. doi: 10.3321/j.issn:1005-8737.2006.01.006Ding Jun, Chang Yaqing, Wang Changhai, et al. Coelomocyte types and enzyme activities of coelomic fluid in sea urchines[J]. Journal of Fishery Sciences of China, 2006, 13(1): 33−38. doi: 10.3321/j.issn:1005-8737.2006.01.006 [12] Eliseikina M G, Magarlamov T Y. Coelomocyte morphology in the holothurians Apostichopus japonicus (Aspidochirota: Stichopodidae) and Cucumaria japonica (Dendrochirota: Cucumariidae)[J]. Russian Journal of Marine Biology, 2002, 28(3): 197−202. doi: 10.1023/A:1016801521216 [13] 于明志, 王婷, 张峰. 罗氏海盘车(Asterias rollestoni Bell)体腔细胞及免疫功能的初步研究[J]. 现代生物医学进展, 2008, 8(8): 1452−1456.Yu Mingzhi, Wang Ting, Zhang Feng. Preliminary study on the function of coelomocyte of The Roche sea jigger (Asterias rollestoni Bell)[J]. Progress in Modern Biomedicine, 2008, 8(8): 1452−1456. [14] 李玉梅, 李书娴, 李向上, 等. 第三代测序技术在转录组学研究中的应用[J]. 生命科学仪器, 2018, 16(Z1): 114−121+113.Li Yumei, Li Shuxian, Li Xiangshang, et al. Transcriptome studies with the third-generation sequencing technology[J]. Life Science Instruments, 2018, 16(Z1): 114−121+113. [15] Stahl F, Hitzmann B, Mutz K, et al. Transcriptome analysis[M]//Hu W S, Zeng A P. Genomics and Systems Biology of Mammalian Cell Culture. Berlin: Springer, 2011: 1−25. [16] 宋尚桥, 马围围, 张超龙, 等. 基于转录组测序生物信息学分析的研究进展[J]. 中国畜牧兽医, 2020, 47(2): 392−398.Song Shangqiao, Ma Weiwei, Zhang Chaolong, et al. Advances in bioinformatics analysis based on transcriptome sequencing[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(2): 392−398. [17] Qi Zhitao, Wu Ping, Zhang Qihuan, et al. Transcriptome analysis of soiny mullet (Liza haematocheila) spleen in response to Streptococcus dysgalactiae[J]. Fish & Shellfish Immunology, 2016, 49: 194−204. [18] Gao Qiong, Liao Meijie, Wang Yingeng, et al. Transcriptome analysis and discovery of genes involved in immune pathways from coelomocytes of Sea Cucumber (Apostichopus japonicus) after Vibrio splendidus challenge[J]. International Journal of Molecular Sciences, 2015, 16(7): 16347−16377. doi: 10.3390/ijms160716347 [19] Zhu Qihui, Zhang Linlin, Li Li, et al. Expression characterization of stress genes under high and low temperature stresses in the Pacific Oyster, Crassostrea gigas[J]. Marine Biotechnology, 2016, 18(2): 176−188. doi: 10.1007/s10126-015-9678-0 [20] Shen Heding, Li Kai, Chen Hanchun, et al. Experimental ecology and hibernation of Onchidium struma (Gastropoda: Pulmonata: Systellommatophora)[J]. Journal of Experimental Marine Biology and Ecology, 2011, 396(2): 71−76. doi: 10.1016/j.jembe.2010.09.010 [21] Li Qiang, Ren Yuan, Liang Chunlei, et al. Regeneration of coelomocytes after evisceration in the sea cucumber, Apostichopus japonicus[J]. Fish & Shellfish Immunology, 2018, 76: 266−271. [22] 李华, 陈静, 陆佳, 等. 仿刺参体腔细胞和血细胞类型及体腔细胞数量研究[J]. 水生生物学报, 2009, 33(2): 207−213. doi: 10.3724/SP.J.1035.2009.00207Li Hua, Chen Jing, Lu Jia, et al. Type and quantity of blood cells and coelomocytes in Apostichopus japonicus[J]. Acta Hydrobiologica Sinica, 2009, 33(2): 207−213. doi: 10.3724/SP.J.1035.2009.00207 [23] 沈和定, 陈汉春, 陈贤龙, 等. 石磺繁殖生物学的实验研究[J]. 水产学报, 2006, 30(6): 753−760.Shen Heding, Chen Hanchun, Chen Xianlong, et al. Experimental study on the reproductive biology of Onchidium sp.[J]. Journal of Fisheries of China, 2006, 30(6): 753−760. [24] 黄金田, 沈伯平, 王资生. 瘤背石磺的生态习性观察[J]. 海洋渔业, 2004, 26(2): 103−109. doi: 10.3969/j.issn.1004-2490.2004.02.006Huang Jintian, Chen Boping, Wang Zisheng. The observation on ecological habits of Onchidium struma[J]. Marine Fisheries, 2004, 26(2): 103−109. doi: 10.3969/j.issn.1004-2490.2004.02.006 [25] 王轶南, 穆晓虎, 封妮莎, 等. 仿刺参体腔液中酚氧化酶活性的分析[J]. 大连海洋大学学报, 2013, 28(4): 319−322. doi: 10.3969/j.issn.2095-1388.2013.04.001Wang Yi’nan, Mu Xiaohu, Feng Nisha, et al. Analysis of phenoloxidase activity in the coelomic fluid of sea cucumber Apostichopus japonicus[J]. Journal of Dalian Ocean University, 2013, 28(4): 319−322. doi: 10.3969/j.issn.2095-1388.2013.04.001 [26] Parisi M G, Li H, Jouvet L B, et al. Differential involvement of mussel hemocyte sub-populations in the clearance of bacteria[J]. Fish & Shellfish Immunology, 2008, 25(6): 834−840. [27] Musthaq S K S, Kwang J. Evolution of specific immunity in shrimp—A vaccination perspective against white spot syndrome virus[J]. Developmental & Comparative Immunology, 2016, 46(2): 279−290. [28] Li Jun, Zhang Yuehua, Mao Fan, et al. The first morphologic and functional characterization of hemocytes in Hong Kong oyster, Crassostrea hongkongensis[J]. Fish & Shellfish Immunology, 2018, 81: 423−429. [29] 何秀娟, 施志仪, 陈晓武, 等. 内脏团插核术刺激对三角帆蚌血细胞的影响[J]. 水生生物学报, 2010, 34(2): 410−417.He Xiujuan, Shi Zhiyi, Chen Xiaowu, et al. Effect pearl-nucleus-inserting operation in visceral mass on haemocytes in Hyriopsis cumingii lea[J]. Acta Hydrobiologica Sinica, 2010, 34(2): 410−417. [30] 潘辉, 高如承, 吴丽云, 等. 利用流式细胞术研究3种贝类的血细胞分类[J]. 福建师范大学学报(自然科学版), 2011, 27(4): 127−130.Pan Hui, Gao Rucheng, Wu Liyun, et al. Flow cytometry studies on haemocyte classification in three species of Bivalve Mollusks[J]. Journal of Fujian Normal University (Natural Science Edition), 2011, 27(4): 127−130. [31] 李乾坤, 张桂蓉, 魏开建, 等. 橄榄蛏蚌血细胞形态及吞噬能力的初步研究[J]. 水生态学杂志, 2012, 33(3): 116−121.Li Qiankun, Zhang Guirong, Wei Kaijian, et al. A preliminary study on morphology and phagocytic ability of hemocytes from Solenaia oleivora (Bivalvia: Unionidae)[J]. Journal of Hydroecology, 2012, 33(3): 116−121. [32] 李霞, 王斌, 刘静, 等. 虾夷马粪海胆体腔细胞的类型及功能[J]. 中国水产科学, 2003, 10(5): 381−385. doi: 10.3321/j.issn:1005-8737.2003.05.006Li Xia, Wang Bin, Liu Jing, et al. Type and function of coelomocyte in sea urchin Strongylocentrotus intermedius[J]. Journal of Fishery Sciences of China, 2003, 10(5): 381−385. doi: 10.3321/j.issn:1005-8737.2003.05.006 [33] Liao W Y, Fugmann S D. Lectins identify distinct populations of coelomocytes in Strongylocentrotus purpuratus[J]. PLoS One, 2017, 12(11): e0187987. doi: 10.1371/journal.pone.0187987 [34] San Miguel-Ruiz J E, García-Arrarás J E. Common cellular events occur during wound healing and organ regeneration in the sea cucumber Holothuria glaberrima[J]. BMC Developmental Biology, 2007, 7: 115. doi: 10.1186/1471-213X-7-115 [35] 邢丽丽. 刺参体色发生生理特征与调控机制的基础研究[D]. 青岛: 中国科学院海洋研究所, 2019.Xing Lili. Basic research on physiological characteristics and regulation mechanism of body color formation in sea cucumber, Apostichopus japonicus[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences, 2019. [36] Wang Chenghui, Wachholtz M, Wang Jun, et al. Analysis of the skin transcriptome in two oujiang color varieties of common carp[J]. PLoS One, 2014, 9(3): e90074. doi: 10.1371/journal.pone.0090074 [37] Bagnara J T, Matsumoto J. Comparative anatomy and physiology of pigment cells in nonmammalian tissues[M]//Nordlund J J, Boissy R E, Hearing V J, et al. The Pigmentary System, Physiology and Pathophysiology. 2nd ed. Oxford: Oxford University Press, 2007: 11−59. [38] 徐伟, 李池陶, 曹顶臣, 等. 几种鲤鲫鳞片色素细胞和体色发生的观察[J]. 水生生物学报, 2007(1): 67−72. doi: 10.3321/j.issn:1000-3207.2007.01.010Xu Wei, Li Chitao, Cao Dingchen, et al. Observation on scale chromatophore and body color’s genesis of carp and cruscian carp[J]. Acta Hydrobiologica Sinica, 2007(1): 67−72. doi: 10.3321/j.issn:1000-3207.2007.01.010 [39] 孟繁伊, 麦康森, 马洪明, 等. 棘皮动物免疫学研究进展[J]. 生物化学与生物物理进展, 2009, 36(7): 803−809.Meng Fanyi, Mai Kangsen, Ma Hongming, et al. The evolution of echinoderm immunology[J]. Progress in Biochemistry and Biophysics, 2009, 36(7): 803−809. [40] 佘秋新. 昼夜节律及褪黑激素对中华绒螯蟹(Eriocheir sinensis)免疫酶和抗氧化酶活性的影响[D]. 沈阳: 沈阳农业大学, 2019.She Qiuxin. Impacts of circadian rhythm and melatonin on the specific activities of immune and antioxidant enzymes of the Chinese mitten crab (Eriocheir sinensis)[D]. Shenyang: Shenyang Agricultural University, 2019. [41] Ray P D, Huang B W, Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling[J]. Cellular Signalling, 2012, 24(5): 981−990. doi: 10.1016/j.cellsig.2012.01.008 [42] Wu Xianjian, Cao Wei, Jia Gang, et al. New insights into the role of spermine in enhancing the antioxidant capacity of rat spleen and liver under oxidative stress[J]. Animal Nutrition, 2017, 3(1): 85−90. doi: 10.1016/j.aninu.2016.11.005 [43] Söderhäll K, Cerenius L. Role of the prophenoloxidase-activating system in invertebrate immunity[J]. Current Opinion in Immunology, 1998, 10(1): 23−28. doi: 10.1016/S0952-7915(98)80026-5 [44] 赵旺, 杨蕊, 吴开畅, 等. “翻背症”对方斑东风螺主要消化酶及免疫相关酶的影响[J]. 水产学报, 2020, 44(9): 1502−1512.Zhao Wang, Yang Rui, Wu Kaichang, et al. Effects of “reverse back syndrome” on main digestive enzymes and immune-related enzymes in Babylonia areolata[J]. Journal of Fisheries of China, 2020, 44(9): 1502−1512. [45] 党慧凤, 张腾, 黎睿君, 等. 饲料中添加壳寡糖对仿刺参肠、触手、体壁、体腔液免疫指标的影响[J]. 黑龙江畜牧兽医, 2019(5): 21−30.Dang Huifeng, Zhang Teng, Li Ruijun, et al. Effect of adding chitooligosaccharide on immunological indexes of intestine, tentacles, body wall and coelomic fluid of sea cucumber (Aposticopus japonicus)[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(5): 21−30. [46] 杨铁柱. 瘤背石磺潮汐感知的分子机制探究[D]. 上海: 上海海洋大学, 2020.Yang Tiezhu. Molecular mechanism of tidal sensing in Onchidium reveesii[D]. Shanghai: Shanghai Ocean University, 2020. [47] 高琼. 刺参体腔细胞转录组测序与抗灿烂弧菌感染相关免疫基因的筛选及表达研究[D]. 青岛: 中国海洋大学, 2015.Gao Qiong. Transcriptome sequencing of coelomocytes and identification and expression of immune-related genes after Vibrio splendidus infection[D]. Qingdao: Ocean University of China, 2015. [48] Oskars T R, Bouchet P, Malaquias M A E. A new phylogeny of the cephalaspidea (Gastropoda: Heterobranchia) based on expanded taxon sampling and gene markers[J]. Molecular Phylogenetics and Evolution, 2015, 89: 130−150. doi: 10.1016/j.ympev.2015.04.011 -



 下载:
下载: