Effects of litter decomposition of Gracilaria lemaneiformis segments on environment and its succession characteristics of bacterial community
-
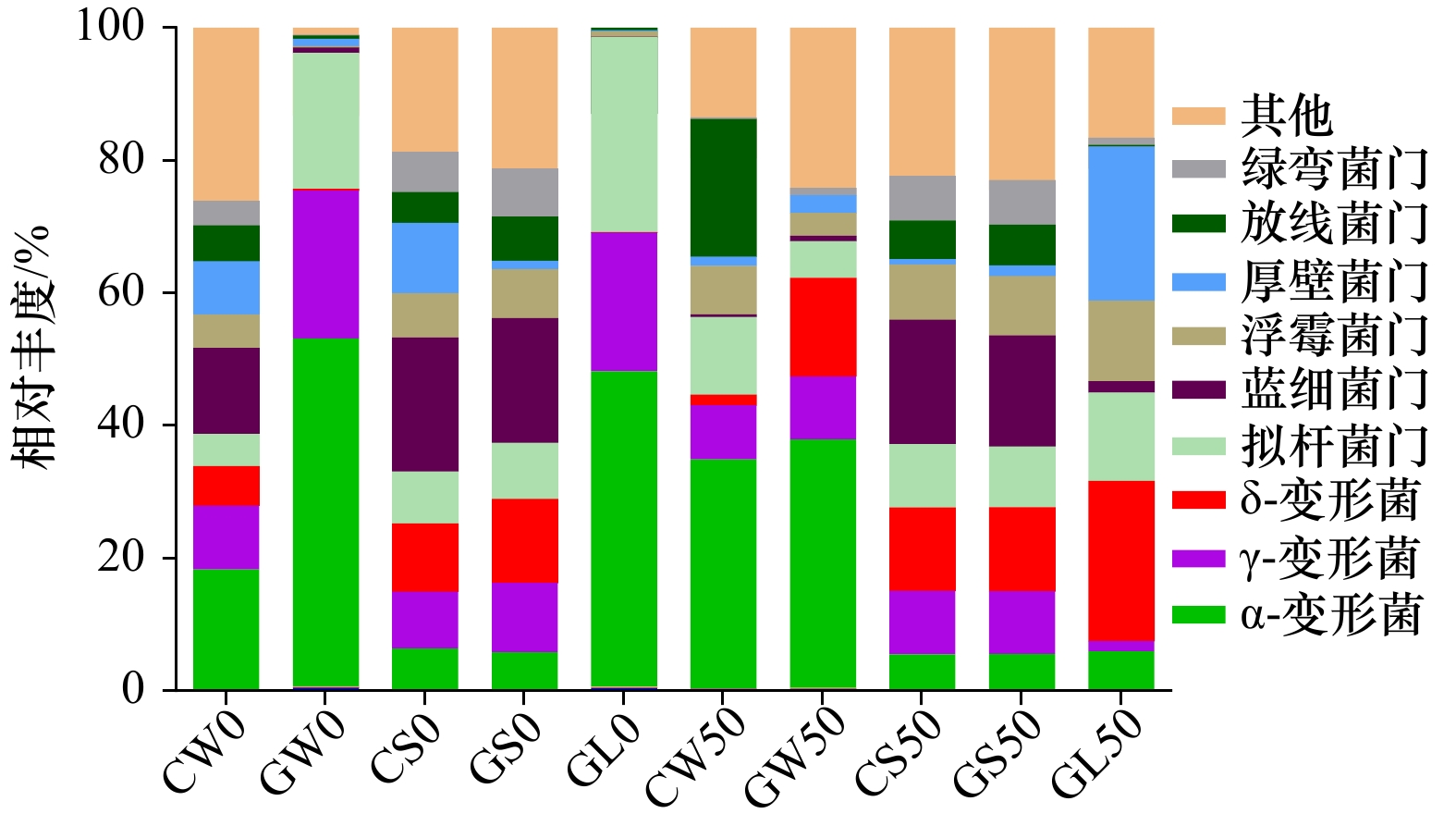
摘要: 为解析大型海藻龙须菜(Gracilaria lemaneiformis)阴干藻段凋落分解对环境的影响及细菌群落演替规律,本文通过室内模拟凋落实验,分析了龙须菜凋落物分解过程中营养盐含量变化及藻体、水体、沉积物细菌群落结构特征。结果发现,龙须菜阴干藻段在较短时间内迅速凋落分解,50 d时,藻体分解率达到83.5%。凋落过程中,水体总有机碳、总氮、总磷的含量分别较初始时升高了241.2%、229.8%和101.3%。水体溶解氧含量从初始的1.87 mg/L降至第50天的0.32 mg/L,降幅达82.9%。凋落过程中,龙须菜藻体附着细菌数量维持在107 copy/g。凋落物藻体附着细菌丰富度与多样性在凋落分解过程中持续升高。优势菌群落结构变化受水体总有机碳、总氮、总磷和溶解氧含量影响显著,其中浮霉菌门、螺旋体门、厚壁菌门、δ-变形菌相对丰度不断上升,拟杆菌门、α-变形菌、γ-变形菌相对丰度不断下降。凋落过程中,凋落物藻体附着细菌中与代谢相关的功能基因丰度持续下降。结果表明,龙须菜藻体凋落会导致水体营养盐浓度升高,浮霉菌门、螺旋体门、厚壁菌门、δ-变形菌等细菌对龙须菜的凋落分解具有重要作用。Abstract: In order to clarify the effects of litter decomposition of Gracilaria lemaneiformis segments on environment and the succession of bacterial community, the characteristics of nutrient content in seaweed, water and sediment, and succession characteristics of bacterial community attached to the seaweed, water and sediment were carried out by the simulation experiment. The results showed that its decomposition rate reached 83.5% after 50 d. The content of total organic carbon (TOC), total nitrogen (TN) and total phosphorus (TP) in water increased by 241.2%, 229.8% and 101.3%, respectively, compared with the initial period. The content of dissolved oxygen (DO) in water decreased by 82.9%, which from 1.87 mg/L to 0.32 mg/L. In addition, the number of bacteria attached to G. lemanei-formis remained at 107 copy/g, while the richness and diversity of bacteria continued to increase during the decomposition processes. The bacteria community structure was significantly affected by total organic carbon, total nitrogen, total phosphorus and DO in water. The relative abundances of Planctomycetes, Spirochaetae, Firmicutes and δ-Proteobacteria increased, while that of Bacteroidetes, α-Proteobacteria and γ-Proteobacteria decreased. During the process of decomposition, the functional gene abundance of metabolism attached to G. lemaneiformis continued to decline. Briefly, the results indicated that decomposition of G. lemaneiformis segments would lead to the increasing of nutrient concentration in water. And Planctomycetes, Spirochaetae, Firmicutes and δ-Proteobacteria played important roles in the process of decomposing of G. lemaneiformis.
-
Key words:
- Gracilaria lemaneiformis /
- decompose /
- environmental factors /
- bacterial community
-
图 1 龙须菜凋落物干重(A)、藻体总碳(B)、总氮(C)、总磷(D)剩余量变化情况
不同小写字母表示龙须菜组不同时间点的数据差异显著(p < 0.05)
Fig. 1 Changes of dry weight (A), total carbon (B), total nitrogen (C), and total phosphorus (D) remaining contents of the Gracilaria lemaneiformis litter
Different lowercase letters indicated significant difference in data at different time points in the Gracilaria lemaneiformis group (p < 0.05)
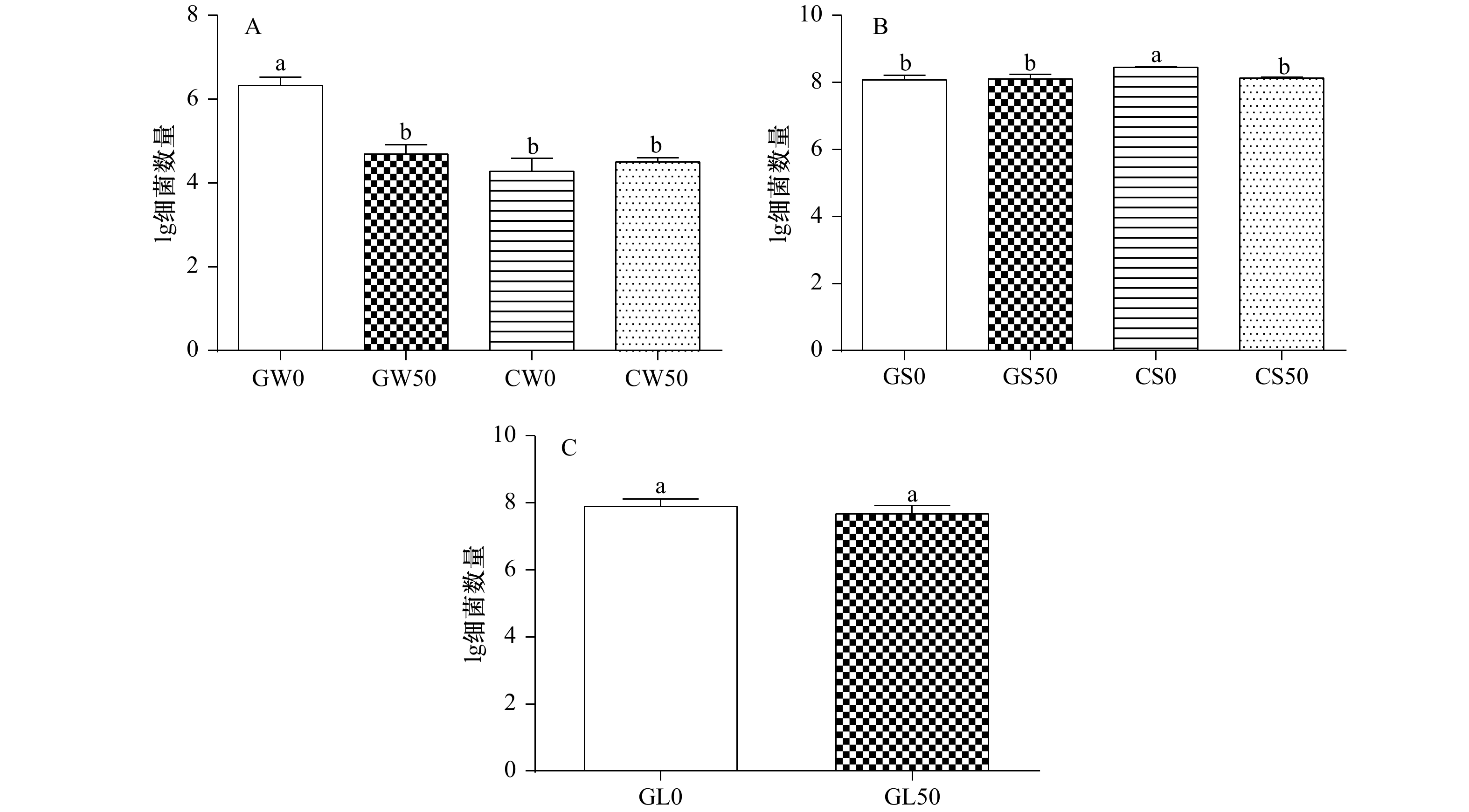
图 2 实验始末水体(A)、沉积物(B)、龙须菜藻体附着(C)细菌数量的比较
GW0和GW50分别表示第0天和第50天龙须菜组的水体样本;CW0和CW50分别表示第0天和第50天对照组的水体样本;GS0和GS50分别表示第0天和第50天龙须菜组的沉积物样本;CS0和CS50分别表示第0天和第50天对照组的沉积物样本;GL0和GL50分别表示第0天和第50天的凋落物藻体附着样本;图A细菌数量单位为copy/mL,图B、C细菌数量单位为copy/g
Fig. 2 Composition of bacterial number in water (A), sediment (B) and surface of Gracilaria lemaneiformis litter (C) at the beginning and end of the experiment
GW0 and GW50 represent water samples from Gracilaria lemaneiformis group at 0 d and 50 d; CW0 and CW50 represent water samples from control group at 0 d and 50 d; GS0 and GS50 represent sediment samples from Gracilaria lemaneiformis group at 0 d and 50 d; CS0 and CS50 represent sediment samples from control group at 0 d and 50 d; GL0 and GL50 represent the samples from surface of Gracilaria lemaneiformis litter at 0 d and 50 d, respectively; the unit of bacteria number in Fig A is copy/mL, the unit of bacteria number in Fig B, C is copy/g
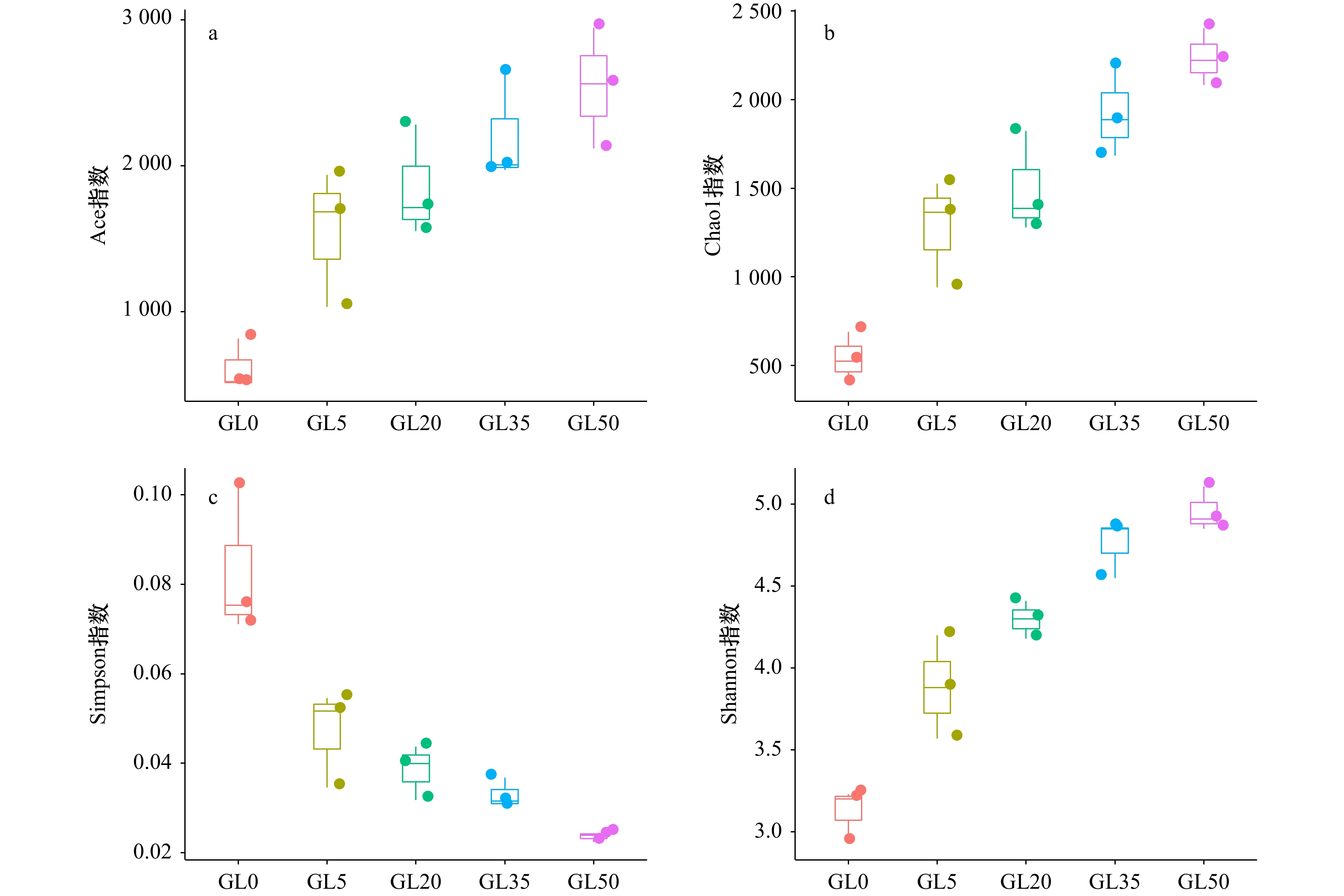
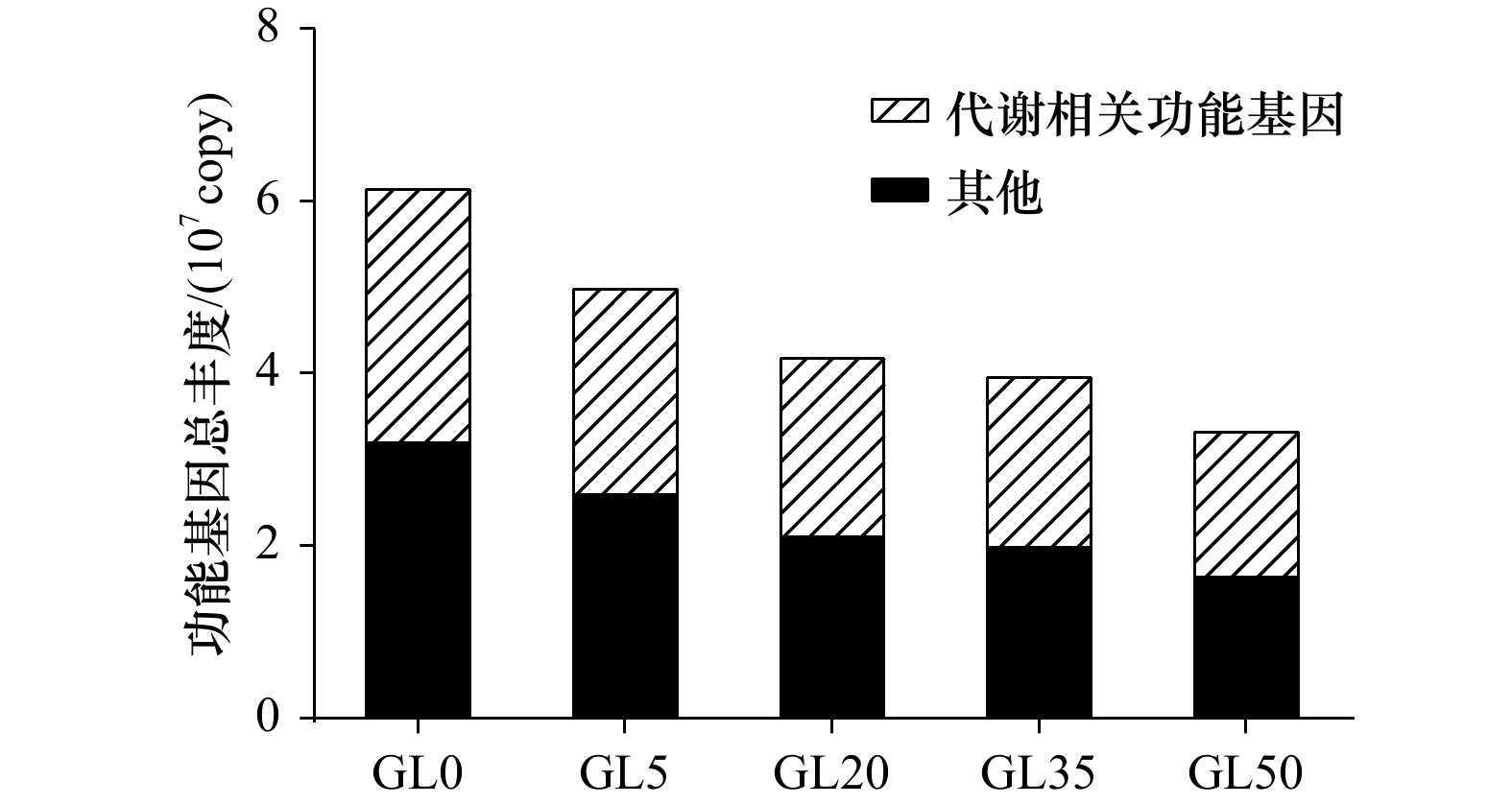
图 4 龙须菜凋落过程藻体附着细菌数量(单位:copy/g)
GL0、GL5、GL20、GL35和GL50分别表示第0天、第5天、第20天、第35天和第50天的凋落物藻体附着样本
Fig. 4 Number of bacteria attached to Gracilaria lemaneiformis litter (unit: copy/g)
GL0, GL5, GL20, GL35 and GL50 represent the samples from surface of Gracilaria lemaneiformis litter at 0 d, 5 d , 20 d, 35 d and 50 d, respectively
表 1 龙须菜凋落过程中水体和沉积物理化环境特征
Tab. 1 Physicochemical properties of the water and sediment during Gracilaria lemaneiformis litter decomposition periods
环境特征 第0天 第5天 第20天 第35天 第50天 对照组 龙须菜组 对照组 龙须菜组 对照组 龙须菜组 对照组 龙须菜组 对照组 龙须菜组 水温/℃ 18.40 ± 0B 18.27 ± 0.12b 21.20 ± 0A 21.27 ± 0.06a 21.09 ± 0.08A 21.08 ± 0.07a 16.79 ± 0.07D 16.86 ± 0.08c 17.98 ± 0.03C 18.06 ± 0.04b 盐度 29.74 ± 0.05A 29.71 ± 0.16a 29.59 ± 0.08A 29.53 ± 0.17a 29.77 ± 0.12A 29.87 ± 0.21a 29.94 ± 0.12A 30.09 ± 0.28a 29.93 ± 0.13A 30.25 ± 0.18a pH 7.80 ± 0.02A 7.68 ± 0.05a 7.59 ± 0.02B 6.73 ± 0.12c 7.59 ± 0.02B 6.89 ± 0.14bc 7.37 ± 0.06D 6.90 ± 0.10bc 7.50 ± 0C 7.13 ± 0.12b 溶解氧含量/
(mg·L−1)2.06 ± 0.03C 1.87 ± 0.06a 2.53 ± 0.14B 0.07 ± 0.02c 2.56 ± 0.30B 0.14 ± 0.02c 3.63 ± 0.36A 0.29 ± 0.04b 3.47 ± 0.20A 0.32 ± 0.03b 水体总有机碳
含量/(mg·L−1)2.10 ± 0.28A 2.62 ± 0.36c 2.39 ± 0.32A 6.24 ± 0.58b 2.07 ± 0.18A 10.25 ± 0.48a 2.41 ± 0.41A 8.57 ± 1.19a 2.38 ± 0.23A 8.94 ± 0.48a 水体总氮含量/
(mg·L−1)4.65 ± 0.11B 12.67 ± 0.68e 11.23 ± 2.50A 16.83 ± 1.95de 9.04 ± 1.80A 22.23 ± 2.28c 5.18 ± 0.79B 31.38 ± 4.55b 5.10 ± 0.51B 41.78 ± 2.54a 水体总磷
含量/(mg·L−1)0.23 ± 0A 0.75 ± 0.06c 0.17 ± 0B 0.74 ± 0.33c 0.18 ± 0.04AB 1.57 ± 0.23a 0.08 ± 0.03C 1.29 ± 0.07ab 0.09 ± 0.02C 1.51 ± 0.26a 沉积物总碳
含量/(mg·g−1)60.97 ± 2.22A 62.07 ± 1.17a \ 59.37 ± 1.62a \ 58.77 ± 1.65a \ 58.80 ± 2.65a 57.63 ± 2.15A 50.50 ± 9.28a 沉积物总氮
含量/(mg·g−1)7.33 ± 0.21A 7.33 ± 0.15a \ 7.57 ± 0.12a \ 6.97 ± 0.21a \ 7.20 ± 0.35a 7.03 ± 0.42A 6.20 ± 1.13a 沉积物总磷
含量/(mg·g−1)0.81 ± 0.03A 0.82 ± 0.02a \ 0.78 ± 0.01a \ 0.76 ± 0.02a \ 0.80 ± 0.04a 0.81 ± 0.06A 0.81 ± 0.22a 注:同行不同大写字母表示对照组间不同时间点的数据差异显著(p < 0.05),同行不同小写字母表示龙须菜组间不同时间点的数据差异显著(p < 0.05);“\”代表未测定。 -
[1] 王秀良, 张全斌, 段德麟. 经济海藻繁育、养殖及综合利用的回顾与展望[J]. 海洋科学, 2020, 44(7): 10−15.Wang Xiuliang, Zhang Quanbin, Duan Delin. Perspective on propagation, cultivation and utilization of economical seaweeds[J]. Marine Sciences, 2020, 44(7): 10−15. [2] Hwang E K, Yotsukura N, Pang S J, et al. Seaweed breeding programs and progress in eastern Asian countries[J]. Phycologia, 2019, 58(5): 484−495. doi: 10.1080/00318884.2019.1639436 [3] Hurtado A Q, Neish I C, Critchley A T. Phyconomy: the extensive cultivation of seaweeds, their sustainability and economic value, with particular reference to important lessons to be learned and transferred from the practice of eucheumatoid farming[J]. Phycologia, 2019, 58(5): 472−483. doi: 10.1080/00318884.2019.1625632 [4] 吴飞燕. 大型海藻脆江蓠与龙须菜多糖抗炎抗肿瘤活性研究[D]. 广州: 暨南大学, 2018.Wu Feiyan. Anti-inflammatory and anticancer activity of polysaccharides from the seaweeds Gracilaria chouae and G. lemaneiformis[D]. Guangzhou: Jinan University, 2018. [5] 李雅婷, 陈明, 曾帅霖, 等. 饲料中添加龙须菜对眼斑拟石首鱼生长、脂肪酸组成、免疫及肠道的影响[J]. 南方水产科学, 2016, 12(1): 85−93. doi: 10.3969/j.issn.2095-0780.2016.01.012Li Yating, Chen Ming, Zeng Shuailin, et al. Effect of dietary Gracilaria lemaneiformis on growth performance, fatty acid composition, immunity and intestinal histology of red drum (Sciaenops ocellatus)[J]. South China Fisheries Science, 2016, 12(1): 85−93. doi: 10.3969/j.issn.2095-0780.2016.01.012 [6] 杨宇峰, 罗洪添, 王庆, 等. 大型海藻规模栽培是增加海洋碳汇和解决近海环境问题的有效途径[J]. 中国科学院院刊, 2021, 36(3): 259−269. doi: 10.16418/j.issn.1000-3045.20210217103Yang Yufeng, Luo Hongtian, Wang Qing, et al. Large-scale cultivation of seaweed is effective approach to increase marine carbon sequestration and solve coastal environmental problems[J]. Bulletin of Chinese Academy of Sciences, 2021, 36(3): 259−269. doi: 10.16418/j.issn.1000-3045.20210217103 [7] 王首吉, 杜虹, 梅志平, 等. 春季深澳湾龙须菜固碳量及其影响因素[J]. 海洋环境科学, 2016, 35(3): 343−348. doi: 10.13634/j.cnki.mes.2016.03.004Wang Shouji, Du Hong, Mei Zhiping, et al. Carbon fixation of Gracilaria lemaneiformis and its environmental regulation in Shen’ao Bay in spring[J]. Marine Environmental Science, 2016, 35(3): 343−348. doi: 10.13634/j.cnki.mes.2016.03.004 [8] Mawi S, Krishnan S, Din M F, et al, Bioremediation potential of macroalgae Gracilaria edulis and Gracilaria changii co-cultured with shrimp wastewater in an outdoor water recirculation system[J]. Environmental Technology & Innovation, 2020, 17: 100571. [9] 何培民, 刘媛媛, 张建伟, 等. 大型海藻碳汇效应研究进展[J]. 中国水产科学, 2015, 22(3): 588−595.He Peimin, Liu Yuanyuan, Zhang Jianwei, et al. Research progress on the effects of macroalgae on carbon sink[J]. Journal of Fishery Sciences of China, 2015, 22(3): 588−595. [10] 邹敏. 不同环境要素影响下大型海藻碎屑分解研究[D]. 上海: 上海海洋大学, 2017.Zou Min. Study on decomposition of macroalgae debris under different environment factors[D]. Shanghai: Shanghai Ocean University, 2017. [11] Blomster J, Back S, Fewer D P, et al. Novel morphology in Enteromorpha (Ulvophyceae) forming green tides[J]. American Journal of Botany, 2002, 89(11): 1756−1763. doi: 10.3732/ajb.89.11.1756 [12] 王云祥, 李正, 秦传新, 等. 不同季节江蓠脱落物对大型海藻场上覆水的影响[J]. 南方水产科学, 2016, 12(2): 13−20. doi: 10.3969/j.issn.2095-0780.2016.02.003Wang Yunxiang, Li Zheng, Qin Chuanxin, et al. Effect of Gracilaria confervoides after falling off on overlying water of seaweed field in different seasons[J]. South China Fisheries Science, 2016, 12(2): 13−20. doi: 10.3969/j.issn.2095-0780.2016.02.003 [13] 戴晓娟, 胡韧, 罗洪添, 等. 大型海藻龙须菜凋落物分解对水质的影响[J]. 热带海洋学报, 2021, 40(1): 91−98.Dai Xiaojuan, Hu Ren, Luo Hongtian, et al. Effects of the decomposition of Gracilaria lemaneiformis on seawater quality[J]. Journal of Tropical Oceanography, 2021, 40(1): 91−98. [14] 刘雨蒙, 章守宇, 周曦杰, 等. 枸杞岛海藻场大型海藻凋落物碳氮稳定同位素分析[J]. 上海海洋大学学报, 2016, 25(3): 438−444. doi: 10.12024/jsou.20160101633Liu Yumeng, Zhang Shouyu, Zhou Xijie, et al. C/N stable isotope analysis of macro algae litters in kelp bed in Gouqi Island[J]. Journal of Shanghai Ocean University, 2016, 25(3): 438−444. doi: 10.12024/jsou.20160101633 [15] O’mullan G D, Juhl A R, Reichert R, et al. Patterns of sediment-associated fecal indicator bacteria in an urban estuary: Benthic-pelagic coupling and implications for shoreline water quality[J]. Science of the Total Environment, 2019, 656: 1168−1177. doi: 10.1016/j.scitotenv.2018.11.405 [16] 王晓妍. 大型海藻及其凋落物附着生物多样性研究[D]. 广州: 暨南大学, 2021.Wang Xiaoyan. Biodiversity studies of epiphytic organisms on seaweeds and their litter[D]. Guangzhou: Jinan University, 2021. [17] 何培民, 段元亮, 刘巧, 等. 我国近海大型海藻生态修复策略与典型案例[J]. 应用海洋学学报, 2021, 40(4): 557−563. doi: 10.3969/J.ISSN.2095-4972.2021.04.001He Peimin, Duan Yuanliang, Liu Qiao, et al. Strategy of macroalgae eco-remediation with cases in nearshore China[J]. Journal of Applied Oceanography, 2021, 40(4): 557−563. doi: 10.3969/J.ISSN.2095-4972.2021.04.001 [18] Yang Y F, Chai Z Y, Wang Q, et al. Cultivation of seaweed Gracilaria in Chinese coastal waters and its contribution to environmental improvements[J]. Algal Research, 2015, 9: 236−244. doi: 10.1016/j.algal.2015.03.017 [19] 刘之威, 罗洪添, 武宇辉, 等. 汕头南澳龙须菜规模栽培对水质和浮游植物的影响[J]. 中国水产科学, 2019, 26(1): 99−107. doi: 10.3724/SP.J.1118.2019.18373Liu Zhiwei, Luo Hongtian, Wu Yuhui, et al. Large-scale cultivation of Gracilaria lemaneiformis in Nan’ao Island of Shantou and its effects on the aquatic environment and phytoplankton[J]. Journal of Fishery Science of China, 2019, 26(1): 99−107. doi: 10.3724/SP.J.1118.2019.18373 [20] Luo Hongtian, Wang Qing, Liu Zhiwei, et al. Potential bioremediation effects of seaweed Gracilaria lemaneiformis on heavy metals in coastal sediment from a typical mariculture zone[J]. Chemosphere, 2020, 245: 125636. doi: 10.1016/j.chemosphere.2019.125636 [21] Xie Xinfei, He Zhili, Hu Xiaojuan, et al. Large-scale seaweed cultivation diverges water and sediment microbial communities in the coast of Nan’ao Island, South China Sea[J]. Science of the Total Environment, 2017, 598: 97−108. doi: 10.1016/j.scitotenv.2017.03.233 [22] 戴晓娟. 大型海藻龙须菜和菊花心江篱凋落物分解过程及其对水环境的影响[D]. 广州, 暨南大学, 2021.Dai Xiaojuan. Litter decomposition process of seaweed Gracilaria lemaneiformis and Gracilaria lichenoides as well as their effects on water environment[D]. Guangzhou: Jinan University, 2021. [23] 赵秀, 胡晓娟, 任丽娟, 等. 汕头南澳海域龙须菜栽培系统细菌群落结构特征[J]. 中国水产科学, 2022, 29(9): 1312−1325.Zhao Xiu, Hu Xiaojuan, Ren Lijuan, et al. Characteristics of bacterial community structure in the cultivation system of Gracilaria lemaneiformis in the Nan’ao area, Shantou[J]. Journal of Fishery Sciences of China, 2022, 29(9): 1312−1325. [24] Zhou Xiaohong, He Zhenli, Ding Fenghua, et al. Biomass decaying and elemental release of aquatic macrophyte detritus in waterways of the Indian River Lagoon Basin, South Florida, USA[J]. Science of the Total Environment, 2018, 635: 878−891. doi: 10.1016/j.scitotenv.2018.04.047 [25] Wang Weiqi, Wang Chun, Sardans J, et al. Storage and release of nutrients during litter decomposition for native and invasive species under different flooding intensities in a Chinese wetland[J]. Aquatic Botany, 2018, 149: 5−16. doi: 10.1016/j.aquabot.2018.04.006 [26] 戴晓玲, 李文红, 章增林, 等. 芋根江蓠和异枝江蓠早期腐解过程及其氮磷释放规律的研究[J]. 上海海洋大学学报, 2016, 25(4): 582−590.Dai Xiaoling, Li Wenhong, Zhang Zenglin, et al. The early decomposition process and the law of nutrient release of Gracilaria blodgettii and Gracilaria bailinae[J]. Journal of Shanghai Ocean University, 2016, 25(4): 582−590. [27] Gessner M O, Chauvet E, Dobson M. A perspective on leaf litter breakdown in streams[J]. Oikos, 1999, 85(2): 377−384. doi: 10.2307/3546505 [28] Melin E. Biological decomposition of some types of litter from North American forests[J]. Ecology, 1930, 11(1): 72−101. doi: 10.2307/1930782 [29] Bocock K L. Changes in the amounts of dry matter, nitrogen, carbon and energy in decomposing woodland leaf litter in relation to the activities of the soil fauna[J]. The Journal of Ecology, 1964, 52(2): 273−284. doi: 10.2307/2257595 [30] Flanagan P W, Van Cleve K. Nutrient cycling in relation to decomposition and organic-matter quality in taiga ecosystems[J]. Canadian Journal of Forest Research, 1983, 13(5): 795−917. doi: 10.1139/x83-110 [31] Hill H H. Decomposition of organic matter in soil[J]. Journal of Agricultural Research, 1926, 33(1): 77−99. [32] 赵秀. 大型海藻龙须菜生长和凋落过程中细菌群落演替特征[D]. 广州: 暨南大学, 2022.Zhao Xiu. Characteristics of bacterial community succession during growth and litter decomposition of seaweed Gracilaria lemaneiformis[D]. Guangzhou: Jinan University, 2022. [33] Wu Suqing, He Shengbing, Zhou Weili, et al. Decomposition characteristics of three different kinds of aquatic macrophytes and their potential application as carbon resource in constructed wetland[J]. Environmental Pollution, 2017, 231: 1122−1133. doi: 10.1016/j.envpol.2017.07.049 [34] 曹勋, 韩睿明, 章婷曦, 等. 冬季水生植物分解过程及其对水质的影响研究[J]. 农业环境科学学报, 2015, 34(2): 361−369. doi: 10.11654/jaes.2015.02.021Cao Xun, Han Ruiming, Zhang Tingxi, et al. Decomposition of aquatic plants during winter and its influence on water quality[J]. Journal of Agro-Environment Science, 2015, 34(2): 361−369. doi: 10.11654/jaes.2015.02.021 [35] 张来甲, 叶春, 李春华, 等. 沉水植物腐解对水体水质的影响[J]. 环境科学研究, 2013, 26(2): 145−151. doi: 10.13198/j.res.2013.02.34.zhanglj.001Zhang Laijia, Ye Chun, Li Chunhua, et al. The effect of submerged macrophytes decomposition on water quality[J]. Research of Environmental Sciences, 2013, 26(2): 145−151. doi: 10.13198/j.res.2013.02.34.zhanglj.001 [36] 王博, 叶春, 杨劭, 等. 腐解黑藻生物量对高硝态氮水体氮素的影响[J]. 环境科学研究, 2009, 22(10): 1198−1203. doi: 10.13198/j.res.2009.10.88.wangb.012Wang Bo, Ye Chun, Yang Shao, et al. Effect of Hydrilla verticillata decomposition biomass on nitrogen content in water containing high concentration of nitrate[J]. Research of Environmental Sciences, 2009, 22(10): 1198−1203. doi: 10.13198/j.res.2009.10.88.wangb.012 [37] 唐金勇, 尹月鹏, 曹熙, 等. 沉积物磷形态空间分布特征及释放风险评估—以沱江流域为例[J]. 中国环境科学, 2022, 42(9): 4264−4273. doi: 10.3969/j.issn.1000-6923.2022.09.034Tang Jinyong, Yin Yuepeng, Cao Xi, et al. Spatial distribution characteristics and release risk assessment of phosphorus forms in sediments: a case study of the Tuojiang River Basin[J]. China Environmental Science, 2022, 42(9): 4264−4273. doi: 10.3969/j.issn.1000-6923.2022.09.034 [38] 张晓华. 海洋微生物学[M]. 2版. 北京: 科学出版社, 2016: 97−102.Zhang Xiaohua. Marine Microbiology[M]. 2nd ed. Beijing: Science Press, 2016: 97−102. [39] 刘冬英, 刘奕, 门学慧, 等. 浮霉菌门严格厌氧产氢细菌(Thermopirellula anaerolimosa)的分离及其生理特性[J]. 微生物学报, 2012, 52(8): 994−1001.Liu Dongying, Liu Yi, Men Xuehui, et al. Isolation and characterization of Thermopirellula anaerolimosa gen. nov., sp. Nov., an obligate anaerobic hydrogen-producing bacterium of the phylum Planctomycetes[J]. Acta Microbiologica Sinica, 2012, 52(8): 994−1001. [40] 魏亚茹, 王怡静, 马巧丽, 等. 粉粒氨氮和水分影响浮霉菌门群落的空间分化[J]. 微生物学通报, 2020, 47(9): 2732−2745. doi: 10.13344/j.microbiol.china.200338Wei Yaru, Wang Yijing, Ma Qiaoli, et al. Effects of silt particles, ammonia nitrogen and water content on structural and functional differentiation of Plantomycetes communities[J]. Microbiology China, 2020, 47(9): 2732−2745. doi: 10.13344/j.microbiol.china.200338 [41] 王彤, 刘倩, 严慧, 等. 基于Meta分析解析羊肠道细菌优势菌群[J]. 中国畜牧杂志, 2021, 57(10): 183−189. doi: 10.19556/j.0258-7033.20201106-01Wang Tong, Liu Qian, Yan Hui, et al. Analysis of dominant bacterial comunity in sheep intestinal tract based on meta-analysis[J]. Chinese Journal of Animal Science, 2021, 57(10): 183−189. doi: 10.19556/j.0258-7033.20201106-01 [42] 张琪, 邓晔, 邵宗泽, 等. 潮间带沉积物厌氧烃降解细菌的多样性及Desulfovibrio subterraneus ND17的分离鉴定[J]. 海洋学报, 2022, 44(8): 78−86.Zhang Qi, Deng Ye, Shao Zongze, et al. Diversity of anaerobic hydrocarbon-degrading bacteria in intertidal sediments and isolation and identification of Desulfovibrio subterraneus ND17[J]. Haiyang Xuebao, 2022, 44(8): 78−86. [43] 齐明明, 李建洋, 刘宪华, 等. 近海沉积物与水体中天然大分子聚合物降解菌的原位富集与多样性分析[J]. 应用海洋学学报, 2020, 39(4): 566−573. doi: 10.3969/J.ISSN.2095-4972.2020.04.013Qi Mingming, Li Jianyang, Liu Xianhua, et al. In situ enrichment and diversity analysis of natural macromolecular polymer degrading bacteria in offshore sediments and water bodies[J]. Journal of Applied Oceanography, 2020, 39(4): 566−573. doi: 10.3969/J.ISSN.2095-4972.2020.04.013 [44] Li Jianyang, Dong Chunming, Lai Qiliang, et al. Frequent occurrence and metabolic versatility of Marinifilaceae bacteria as key players in organic matter mineralization in global deep seas[J]. mSystems, 2022, 7(6): e0086422. doi: 10.1128/msystems.00864-22 [45] 张梦思, 汤海青, 欧昌荣, 等. 采用Illumina MiSeq测序技术比较日本鲭和大黄鱼冷藏期间的腐败特性[J]. 水产学报, 2019, 43(4): 1220−1233.Zhang Mengsi, Tang Haiqing, Ou Changrong, et al. Comparative analysis of the spoilage characteristics of Scomber japonicus and Larimichthys crocea during refrigerated storage by Illumina Miseq sequencing technology[J]. Journal of Fisheries of China, 2019, 43(4): 1220−1233. [46] Sun Fulin, Wang Youshao, Wu Meilin, et al. Spatial and vertical distribution of bacteria in the Pearl River estuary sediment[J]. African Journal of Biotechnology, 2012, 11(9): 2256−2266. -




 下载:
下载: